(11分) 将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868 g·cm-3的氨水。(不考虑氨气与水的反应)
(1)该气体的物质的量= mol;溶液的体积= L;
所得氨水的物质的量浓度= mol·L-1。
(2)若取上述氨水30.0mL与70.0mL2.00mol·L-1的AlCl3溶液相混合,产生白色沉淀的质量是 g。
(3)若取某浓度的NaOH溶液50.0mL与50.0mL2.00mol·L-1的AlCl3溶液相混合,有白色沉淀产生,测得溶液中铝元素与沉淀中铝元素质量相等,则NaOH溶液的物质的量浓度为 mol·L-1
锌是人体生长发育、维持器官正常功能的微量元素,人体缺锌会引起多种疾病,因此缺锌者可通过服用葡萄糖酸锌等保健品来补锌。已知葡萄糖酸锌的化学式为C12H22O14Zn,请回答:
(1)葡萄糖酸锌中含锌元素的质量分数为多少?(结果保留至0.1%)
(2)现有一支20 mL的葡萄糖酸锌口服液,其中含锌6.5 mg,那么该口服液中葡萄糖酸锌的物质的量浓度为多少?
(12分)某合金可能由铜与镁、锌中的一种组成,现欲测定其组成,进行如下实验:取该合金样品10.0 g放入烧杯中,然后将56.0 g溶质质量分数为14.0%的稀硫酸平均分四次依次加入该烧杯中,每次均充分反应。实验数据记录如下表: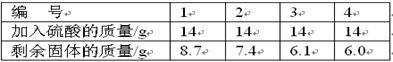
试求:
(1)该合金中铜的质量分数是__________。
(2)该合金除了铜外,另一种金属的是什么呢?(写出过程)
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?(写出计算过程,结果精确到0.1%)
已知: MnO2 +4HCl(浓) MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变)。请计算:
MnCl2 + Cl2↑+ 2H2O。一定质量的二氧化锰溶解在100mL 过量的浓盐酸中,当反应生成4.48L 氯气(标况)时,剩余溶液中盐酸的浓度为1mol/L(假设反应前后体积不变)。请计算:
(1)反应耗用MnO2的质量是______________ ;
(2)被氧化的HCl物质的量是______________ ;
(3)原浓盐酸的物质的量浓度是______________.
(1)已知H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol,则反应HCl(g)═1/2H2(g)+1/2Cl2(g)的△H为 .
(2)已知下列热化学方程式:
①Zn(s)+ O2(g)═ZnO(s)△H1=﹣351.1kJ/mol
O2(g)═ZnO(s)△H1=﹣351.1kJ/mol
②Hg(l)+ O2(g)═HgO(s)△H2=﹣90.7kJ/mol
O2(g)═HgO(s)△H2=﹣90.7kJ/mol
由此可知Zn(s)+HgO(s)═ZnO(s)+Hg(l)△H3,其中△H3为 .
我国北方某盐湖生产的纯碱(Na2CO3)产品中常含少量的氯化钠,为测定该产品中碳酸钠的质量分数,现称取6g样品于烧杯内,滴加稀盐酸至烧杯内溶液的PH=7,消耗稀盐酸的质量为36.5g,同时测得反应后溶液的总质量为40.3g。请计算:
(1)反应生成的气体质量为 g。
(2)该样品中碳酸钠的质量分数。(结果精确至0.1%)