下列实验操作中正确的是
| A.用托盘天平称取3.25gNaCl |
| B.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸液润洗2—3次 |
| C.用碱式滴定管量取12.20mL高锰酸钾 |
| D.先将pH试纸用蒸馏水润湿后,再测定溶液的pH |
下列物质中,不属于电解质的是()
| A.CO2 | B.NaCl | C.H2SO4 | D.KOH |
下列反应既属于离子反应,又属于氧化还原反应的是()
A.CaO+H2O= |
B.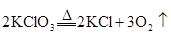 |
C.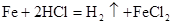 |
D.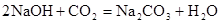 |
下列叙述中正确的是()
A.钠与硫酸铜溶液反应会置换出红色的铜
B.常温下干燥氯气与铁不反应,可以用钢瓶储存液氯
C.CO2、NO2、SO2都能与H2O反应,其反应原理相同
D.C、N、S三种单质直接与O2反应都能生成两种氧化物
下列各组物质中均能造成大气污染的是()
| A.N2、NO2、粉尘、煤烟 | B.CO2、O2、氮的氧化物、碳氢化合物 |
| C.Cl2、N2、煤烟、氮的氧化物 | D.H2S、SO2、粉尘、煤烟、氮的氧化物 |
从化学试剂商店买来的浓硝酸试剂瓶上所贴的危险化学品标志是()