根据相关的化学原理,下列判断正确的是( )
A.由于水中存在氢键,所以稳定性:H2O>H2S
B.由于二氧化硅的相对分子质量比二氧化碳的大,所以沸点:SiO2>CO2 若A2+2D-=2A-+D2,则氧化性:D2>A2
若A2+2D-=2A-+D2,则氧化性:D2>A2
D.若R2-和M+的电子层结构相同,则离子半径:R2->M+
常温下,将一小块铝片投入足量的下列溶液中,铝片不能全部溶解的是()
| A.浓硫酸 | B.稀硫酸 | C.氢氧化钠溶液 | D.稀硝酸 |
胶体的本质是 ( )
| A.具有丁达尔效应 |
| B.可以透过滤纸 |
| C.可做布朗运动 |
| D.分散质微粒的直径在1---100nm之间 |
设NA为阿伏加德罗常数的值,下列叙述正确的是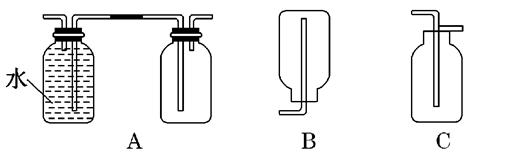
| A.常温常压下,16g14CH4所含中子数目为8NA |
| B.标准状况下,22.4 LSO3所含分子数目为NA |
| C.1 L 0.5 mol·L-1的CH3COONa溶液中所含的CH3COO—离子数目为0.5NA |
| D.6.2g白磷(分子式为P4,分子结构如上图所示)所含P-P键数目为0.3NA |

有a、b、c、d、e五种无色气体,进行下列实验:
| 实验步骤 |
实验现象 |
| ①a和b相混合 |
气体变为红棕色 |
| ②c和d相混合 |
产生白烟 |
| ③c、e分别通入少量溴水中 |
都变成无色透明的溶液 |
| ④b、e分别通入氢硫酸中 |
都产生淡黄色的浑浊 |
a、b、c、d、e依次可能是
A.O2、NO、HCl、NH3、CO2 B.O2、NO、NH3、HCl、SO2
C.NO、O2、NH3、HCl、SO2 D.HBr、Cl2、NH3、H2S、C2H4
A、B都是短周期元素,原子半径:B>A,它们可以形成化合物AB2。由此可得出的正确判断是
A.A、B可能在同一周期 B.A在B的前一周期
C.A肯定是金属元素 D.A可能在第三周期的ⅡA或ⅣA