目前世界上60%的镁是从海水中提取的。学生就这个课题展开了讨论的。已知海水提镁的主要步骤如下:
学生就这个课题提出了以下问题:
(一)在海水提镁的过程中如何实现对镁离子的富集?
有三个学生提出自己的观点。
学生甲的观点:直接往海水中加入沉淀剂。
学生乙的观点:高温加热蒸发海水后,再加入沉淀剂。
学生丙的观点:利用晒盐后的苦卤水,再加入沉淀剂。
请你评价三个学生提出的观点是否正确(填是或否),并简述理由。
| |
是否正确 |
简述理由 |
| 学生甲的观点 |
|
|
| 学生乙的观点 |
|
|
| 学生丙的观点 |
|
|
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是 (填化学式)。
(2)加入的足量试剂②是 (填化学式)。
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是 。
A. |
B.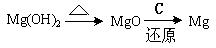 |
C.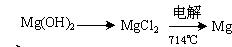 |
D. |
催化剂在生产和科技领域起到重大作用。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题: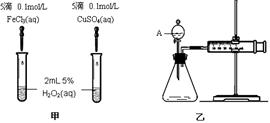
(1)定性分析:如图甲可通过观察,定性比较得出结论。同学乙观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论__________(填“合理”或“不合理”),理由是____________________________。
(2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是 。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如下图所示。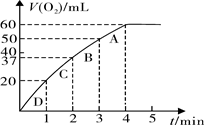
①实验时放出气体的总体积是mL。
②放出1/3气体所需时间为 min。
③计算H2O2的初始物质的量浓度______。(请保留两位有效数字)
④A、B、C、D各点反应速率快慢的顺序为_____>____>___> ____。
⑤解释反应速率变化的原因。
某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。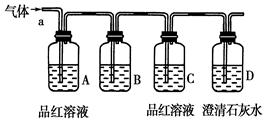
【提出猜想】
猜想1:______________________________,
猜想2:______________________________,
猜想3: ______________________________。
为了验证猜想,该小组设计实验加以探究:
【实验探究】
该小组同学按如图所示装置,将气体从a端通入,则:
(1)B中可以装下列________试剂(填编号)。
| A.NaCl溶液 | B.KMnO4溶液 | C.盐酸 | D.澄清石灰水 E.NaHCO3 溶液 F.碘水 |
(2)A中品红溶液的作用是:_____________________________________。
(3)D中澄清石灰水的作用是:_________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色③D中澄清石灰水变浑浊
【得出结论】
(4)由上述现象该小组同学确认该气体的成分为:______________________。
(5)请写出SO2与氯水发生反应的离子方程式:_________________________。
为测定某生铁(假设仅含Fe和C)粉末状样品中铁的质量分数,某化学研究性学习小组设计有关方案进行如下实验。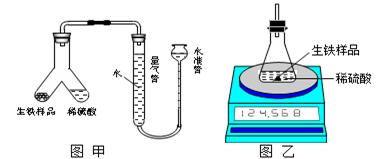
(1)设计如图甲所示装置,使生铁样品与稀硫酸反应的操作为。
实验结束后,读出量气管中的气体体积(换算为标准状况),计算生铁样品中铁的质量分数,测定的结果偏低,可能的原因是。(填字母序号)
A. 反应结束并冷却后,未再次调节量气管和水准管中液面相平, 即读取气体体积
B. 稀硫酸过量
C. 水准管中有少量水溢出
(2)设计如图乙所示装置,测得反应前后的有关质量如表,则生铁样品中铁的质量分数为,根据图中装置判断,若实验中操作没有失误,该实验结果可能。(填“偏大”、“偏小”或 “准确”)
| 反应前:整套装置+ 稀硫酸质量/g |
反应前: 生铁样品质量/g |
反应后:整套装置+ 锥形瓶中剩余物的质量/g |
| a |
m |
b |
(3)若取生铁粉末5.72 g,高温下的氧气流中充分反应,得到CO2气体224 mL(标准状况)。则此生铁粉末中铁和碳的物质的量之比为。若再取三份不同质量的生铁粉末,分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示。计算实验Ⅱ结束后的溶液中,还能溶解生铁样品的质量。
| 实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
| 加入生铁样品的质量/g |
1.43 |
2.86 |
8.58 |
| 生成气体的体积/L(标准状况) |
0.56 |
1.12 |
2.24 |
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实验步骤 |
现象 |
结论 |
| ①分别取等体积的2 mol·L-1硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 |
反应快慢:Mg>Fe>Cu |
反应物的性质越活泼,反应速率越快 |
(1)该同学的实验目的是________________________;要得出正确的实验结论,还需控制的实验条件是________________________________________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用上图装置进行定量实验。完成该实验应选用的实验药品是____________________________;应该测定的实验数据是________________________________________________________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在酸性高锰酸钾溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液退色不明显;但不久突然退色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是________。
A.硫酸钾 B.硫酸锰
C.氯化锰D.水
某同学设计一个实验探究氧化铜的性质,其实验操作是:取A、B两支试管,往A中先加入适量CuO粉末,再分别向A和B中加入等体积的3% H2O2溶液,只观察到A中有大量气泡。
(1)实验结论是
________________________________________________________________________;
(2)为探究试管A中反应的速率,收集气体并测定其体积,必需的实验仪器有:
________________________________________________________________________。