有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且第一电离能I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z为d区原子,且外围电子中有四对成对电子。
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式 、基态Z原子的核外电子排布式 。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 。
(3)化合物甲由T、X两元素组成,其晶胞如图1,甲的化学式为 。
(4)化合物乙的晶胞如图2,乙由E、Q两元素组成,硬度超过金刚石。
①乙的晶体类型为 ,其硬度超过金刚石的原因是 。
②乙的晶体中E、Q两种元素原子的杂化方式分别为 。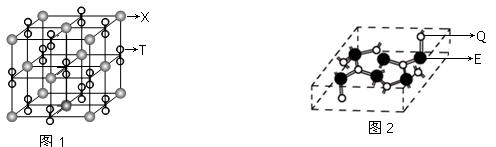
已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2↑;
②Cu+2H2SO4(浓) CuSO4+SO2 ↑ +2H2O。试回答下列问题:
CuSO4+SO2 ↑ +2H2O。试回答下列问题:
(1)反应①中元素被还原,反应②中元素被还原。(填元素符号)
(2)当反应①生成2g H2时,消耗H2SO4的质量是。
(3)反应②中生成32g SO2气体时,消耗H2SO4的质量是 g ,其中有g H2SO4作为氧化剂被还原。
g ,其中有g H2SO4作为氧化剂被还原。
有A、B、 C、D、E五种无色溶液,它们是硝酸钙、稀盐酸、硝酸银、碳酸钠和氯化钡。各取少量进行两两混合实验,结果如下(表中“↓”表示有沉淀出现,“↑
C、D、E五种无色溶液,它们是硝酸钙、稀盐酸、硝酸银、碳酸钠和氯化钡。各取少量进行两两混合实验,结果如下(表中“↓”表示有沉淀出现,“↑
 ”表示有气体生成,“—”表示没有明显现象):
”表示有气体生成,“—”表示没有明显现象):
| A |
B |
C |
D |
E |
|
| A |
 |
↓ |
— |
↓ |
— |
| B |
↓ |
↓ |
— |
||
| C |
— |
↓ |
↑ |
— |
|
| D |
↓ |
↓ |
↑ |
↓ |
|
| E |
— |
— |
— |
↓ |
(1)请写出A、B、C、D 、E各溶液中溶质的化学式:
、E各溶液中溶质的化学式: ABCDE
ABCDE
(2)请写出A+B,C+D,D+E反应的离子方程式
①A+B:
②C+D:
③A+D:
根据要求填写:
(1)金属钠在空气中燃烧,火焰呈色,化学方程式:;
(2)将过氧化钠固体放入试管中加入少量水,再加入几滴酚酞试液,溶液变红色但很快褪色,原因是:,过氧化钠固体与水反应的化学方程式: ;
;
(3)苏打和小苏打分别和同浓度的盐酸反应,反应较快且剧烈的是(填化学式),小苏打与盐酸反应的离子方程式为: ;
;
(4)金属钠和金属钾分别和水反应试验中,其中反应较剧烈的反应的化学方程式:;
 A质子数、B中子数、C质子数和中子数、D最外层电子数、E电子层数,请用单个序号填写下列各空白。
A质子数、B中子数、C质子数和中子数、D最外层电子数、E电子层数,请用单个序号填写下列各空白。
元素的种类由(1)决定;元素的化学性质主要由(2)决定;是否是同位素由(3)决定。
写出 下列物质的电离方程式或者化学
下列物质的电离方程式或者化学 式:
式:
(1)硫酸__________________(电离方程式)
(2)纯碱___________________(化学式)
(3)醋酸______________________(化学式)
(4)大理石的主要成分____________(化学式)