室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的溶度积(室温)为2.8×10-9,下列说法 中不正确的是( )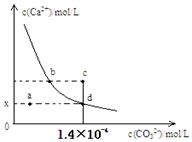
| A.x的数值为2×10-5 |
B.c点时有CaCO3生成 |
| C.加入蒸馏水可使溶液由d点变成a点 | |
| D.b点与d点对应的溶度积相等 |
不能用一种试剂鉴别的一组物质是 ()
| A.苯、乙二醇、四氯化碳 | B.苯酚溶液、2,4-己二烯、甲苯 |
| C.己烷、3--己烯、甲苯 | D.苯酚溶液、硫氰酸钾溶液、氢氧化钠溶液 |
3-甲基戊烷的一氯代物有(不考虑立体异构)()
| A.3种 | B.4种 | C.5种 | D.6种 |
下列各组中的反应,属于同一反应类型的是()
| A.乙烯水化制乙醇;溴乙烷水解制乙醇 |
| B.甲苯使酸性高锰酸钾溶液褪色;丙炔和氢气反应制取丙烷 |
| C.甲苯硝化制TNT;乙炔与氯化氢反应制氯乙烯 |
D.  乙醇脱水制乙烯;溴乙烷脱溴化氢制乙烯 乙醇脱水制乙烯;溴乙烷脱溴化氢制乙烯 |
某烃的结构简式为 CH2=CH-C≡C  ,下列有关其结构的说法正确的是
,下列有关其结构的说法正确的是
| A.所有碳原子可能在同一平面上 | B.最多有11个碳原子在同一平面上 |
| C.最多有5个碳原子在同一直线上 | D.最多有7个碳原子在同一直线上 |
列有关生活常识的说法中,正确的是()
A.棉、毛及合成纤维完全燃烧都只生成 和 和 |
| B.油脂变质后有难闻的气味是由于其发生了化学变化 |
| C.合成高分子材料都难以降解,会造成环境污染 |
| D.食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |