下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断以下叙述正确的是
| 元素代号 |
L |
M |
Q |
R |
T |
| 原子半径/nm |
0.160 |
0.134 |
0.089 |
0.102 |
0.074 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6、-2 |
-2 |
A.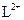 与 与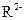 的核外电子数相等 的核外电子数相等 |
B.L与T形成的化合物具有两性 |
C.氢化物的稳定性为 |
D.单质与浓度相等的稀盐酸反应的速率为Q<L |
下列离子方程式书写正确的是
| A.铜与稀硝酸的反应:Cu+4H++2NO3-= Cu2++2NO2↑+2H2O |
B.氯气与水反应:Cl2+H2O H++Cl-+HClO H++Cl-+HClO |
| C.铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ |
下列有关实验操作正确的是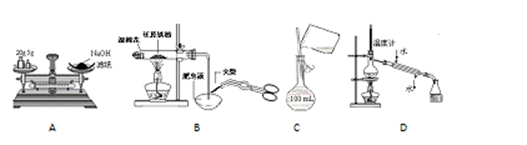
| A.称量氢氧化钠固体 |
| B.检验铁粉与水蒸气反应产生的氢气 |
| C.配制150 mL 0.10 mol·L-1盐酸 |
| D.分离沸点相差较大的液体互溶混合物 |
下列反应属于氧化还原反应,但水既没有做氧化剂又没有做还原剂的是
| A.2F2+2H2O ="4HF" +O2 |
| B.3NO2+H2O =2HNO3+NO |
| C.2Na +2H2O=2NaOH+H2 |
| D.CaO+H2O =Ca(OH)2 |
科学家冶炼出了纯度高达99.9999%的铁,你估计它不会具有的性质是
| A.在潮湿的空气中放置不易生锈 |
| B.硬度比生铁小 |
| C.与3 mol/L盐酸的反应生成氢气 |
| D.与18.4 mol/L的硫酸反应生成氢气 |
某无色透明溶液中存在大量的H+、Cl一、NO3一,该溶液中还可能大量存在的是
| A.HCO3一 | B.Cu2+ | C.NH4+ | D.Ag+ |