下列各溶液中的表述正确的是
| A.0.1 mol·L-1NH4Cl溶液:c(NH4+)=c(Cl-) |
| B.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
| C.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
| D.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子有CO32-、HCO3-、OH- |
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g) 2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。
2NH3(g),673 K、30 MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 ( )。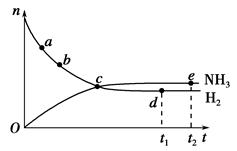
| A.点a的正反应速率比点b的小 |
| B.点c处反应达到平衡 |
| C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样 |
| D.其他条件不变,773 K下反应至t1时刻,n(H2)比上图中d点的值大 |
对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列说法正确的是( )。
2NH3(g) ΔH<0,下列说法正确的是( )。
| A.达到平衡时反应物和生成物浓度一定相等 |
| B.达到平衡后加入氨气,重新达到平衡时,氨气的浓度比原平衡时大 |
| C.达到平衡时,升高温度加快了吸热反应的速率,降低了放热反应的速率,所以平衡向逆反应的方向移动 |
| D.加入催化剂可以缩短到达平衡的时间,这是因为加快了正反应的速率,而减慢了逆反应的速率 |
合成NH3所需的H2可由煤与H2O反应制得,其中有一步反应为CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0。欲提高CO转化率可采用的方法可能有:①降低温度;②增大压强 ③使用催化剂 ④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )。
CO2(g)+H2(g) ΔH<0。欲提高CO转化率可采用的方法可能有:①降低温度;②增大压强 ③使用催化剂 ④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )。
| A.①②③ | B.④⑤ | C.①⑤ | D.⑤ |
合成氨时既要使氨的产率增大,又要使反应速率加快,可采取的办法是( )。
①减压 ②加压 ③升温 ④降温⑤及时从平衡混合气中分离出NH3
⑥补充N2或H2 ⑦加催化剂 ⑧减小N2或H2的量
| A.③④⑤⑦ | B.①②⑤⑥ | C.②⑥ | D.②③⑥⑦ |
下列关于合成氨工业的叙述可用勒夏特列原理来解释的是 ( )。
| A.使用铁触媒,使平衡向生成NH3的方向移动 |
| B.高压比常压条件更有利于合成氨的反应 |
| C.500 ℃左右比室温更有利于合成氨的反应 |
| D.合成氨时采用循环操作可提高原料的利用率 |