关于铅蓄电池的说法正确的是:
| A.充电时外接电源的正极与铅蓄电池的正极相联,电极上发生还原反应。 |
| B.放电时,正极上发生的电极反应式为:Pb(s)+SO42-(aq)==PbSO4(s)+2e- |
| C.放电过程中,正极附近溶液的PH增大。 |
| D.充电时,阳极发生的电极反应式为:PbSO4(s)+2e- ="=" Pb(s)+SO42-(aq) |
高铁酸钾(K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
| A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质 |
| B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质 |
| C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌 |
| D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌 |
将106 g的Na2CO3和84 g NaHCO3先经充分强热后,再分别足量的盐酸反应,下列说法错误的是( )
| A.消耗盐酸一样多 | B.放出CO2的总量一样多 |
| C.后者生成的NaCl是前者的一半 | D.后者消耗盐酸是前者的一半 |
下列化学反应可用离子方程式CO+2H+===CO2↑+H2O表示的是( )
| A.石灰水和盐酸反应 |
| B.难溶的碳酸盐和难电离的酸反应生成CO2和H2O |
| C.可溶性碳酸盐与强酸反应生成CO2和H2O |
| D.可溶性碳酸盐与任何酸反应生成CO2和H2O |
根据下列金属的熔沸点:
其中不能形成合金的是( )
| A.Cu与Al | B.Fe与Cu | C.Fe与Na | D.Al与Na |
如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )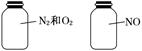
| A.所含原子数相等 | B.气体密度相等 | C.气体质量相等 | D.摩尔质量相等 |