回答下列有关问题:
(1)硫化铵水解的离子方程式为:S2-+NH4++H2O HS-+ NH3·H2O,
HS-+ NH3·H2O,
如何判断溶液的酸碱性: 。
(2)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是: 。有人认为加入FeS作为沉淀剂还可以起到净化水的作用,请你运用所学知识解释:
。
(3)用离子方程式解释泡沫灭火器(将硫酸铝与碳酸氢钠溶液混和)灭火原理:
。
I.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题:
(1)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1中以v (CO2)表示的反应速率为 (保留两位小数,下同)。
②该反应为 (填“吸”或“放”)热反应,实验2条件下平衡常数K= 。
(2)已知在常温常压下:
① 2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH = -1275.6 kJ/mol
② 2CO (g)+ O2(g)= 2CO2(g)ΔH = -566.0 kJ/mol
③ H2O(g)= H2O(l)ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: 。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池某电极的工作原理如下图所示: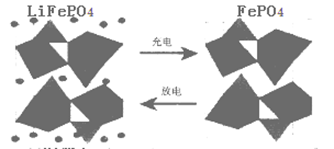
该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的 极(填“正”或“负”),该电极反应式为 。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mole-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是 L,将电解后的溶液加水稀释至1L,此时溶液的pH= 。
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式。
(1)甲烷燃烧放出大量的热,可作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H=" —1214" kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=" —566" kJ/mol
则表示甲烷燃烧热的热化学方程式 。
(2) 将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是: 。
(3)某同学利用甲烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如下图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是 (填序号)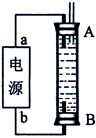
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H+ + 2e-= H2↑
(4)将不同量的CO(g)和H2O(g)分别通入体积
为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)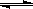 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| H2O |
CO |
CO2 |
|||
| 1 |
650 |
2 |
4 |
1.6 |
5 |
| 2 |
900 |
1 |
2 |
0.4 |
3 |
| 3 |
900 |
1 |
2 |
0.4 |
1 |
①实验1中,以v (H2)表示的平均反应速率为 。
②实验3跟实验2相比,改变的条件可能是 (答一种情况即可)
工业合成氨与制备硝酸一般可连续生产,流程如下: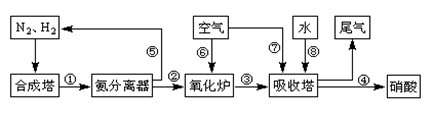
(1)工业生产时,制取氢气的一个反应为:CO(g)+H2O(g)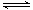 CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
CO2(g)+H2(g)。t℃时,往10L密闭容器中充入2mol CO和3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。则该温度下此反应的平衡常数K= (填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g)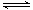 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1 300℃(填“>”、“<”或“=”)。
| T/℃ |
T1 |
300 |
T2 |
| K |
1.00×107 |
2.45×105 |
1.88×103 |
(3)氨气在纯氧中燃烧生成一种单质和水,科学家利用此原理,设计成“氨气-氧气”燃料电池,则通入氨气的电极是 (填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为 。
(4)用氨气氧化可以生产硝酸,但尾气中的NOx会污染空气。目前科学家探索利用燃料气体中的甲烷等将氮的氧化物还原为氮气和水,反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
(5)某研究小组在实验室以“Ag-ZSM-5”为催化剂,测得将NO转化为N2的转化率随温度变化情况如图。据图分析,若不使用CO,温度超过775K,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制的最佳温度在 左右。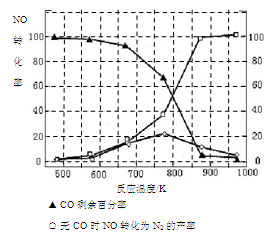
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环。
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸汽和水蒸气。下图表示恒压容器中0.5 mol CO2和1.5 mol H2转化率达80%时的能量变化示意图。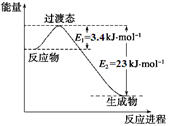
①写出该反应的热化学方程式: 。
②能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂。
(2)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH原理的示意图。根据要求回答问题: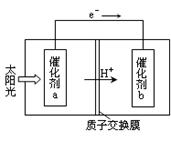
①该过程是将 转化为 。(以上两空选填“电能”“太阳能”“化学能”)
②催化剂b表面的电极反应方程式为 。
(3)某国科研人员提出了使用氢气和汽油(汽油化学式用C8H18表示)混合燃料的方案,以解决汽车CO2的排放问题。该方案主要利用储氢材料CaH2产生H2和用汽油箱贮存汽油供发动机使用,储氢系统又捕集汽油燃烧产生的CO2,该系统反应如下图所示: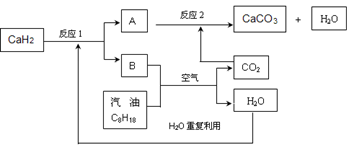
解决如下问题:
①写出CaH2的电子式 。
②反应1中氧化剂与还原剂的物质的量之比是: 。
③如该系统反应均进行完全,试写出该系统总反应的化学方程式 。
随着大气污染的日趋严重,“节能减排”,减少全球温室气体排放,研究NOx、SO2、CO等大气污染气体的处理具体有重要意义。
(1)如图是在101 kPa,298K条件下1mol NO2和1mol CO反应生成1mol CO2和1mol NO过程中的能量变化示意图。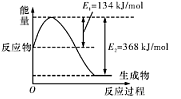
已知:
请写出NO与CO反应生成无污染气体的热化学方
程式: 。
(2)将0.20 mol N02和0.10 mol CO充入一个容积恒定为1L的密闭容器中发生反应,在不同条件下,反应过程中部分物质的浓度变化状况如图所示。
①下列说法正确的是 (填序号)。
a.容器内的压强不发生变化说明该反应达到乎衡
b.当向容器中再充人0. 20 mol NO时,平衡向正反应方向移动,K增大
c.升高温度后,K减小,N02的转化率减小
d.向该容器内充人He气,反应物的体积减小,浓度增大,所以反应速率增大
②计算产物NO在0~2 min内平均反应速率v(NO)= mol·L-1·min-1
③第4 min时改变的反应条件为 (填“升温’’、“降温’’)。
④计算反应在第6 min时的平衡常数K= 。若保持温度不变,此时再向容器中充人CO、NO各0.060 mol,平衡将 移动(填“正向”、“逆向”或“不”)。
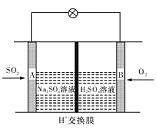
(3)有学者想以如图所示装置用原电池原理将SO2转化为重要的化工原料。其负极反应式为 ,当有0.25 mol SO2被吸收,则通过质子(H+)交换膜的H+的物质的量为 mol。