工业上用含80% FeS2的硫铁矿制取硫代硫酸钠,涉及到的化学反应如下(杂质不与O2、盐酸反应):
4FeS2+11O2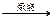 2Fe2O3+8SO2 ①
2Fe2O3+8SO2 ①
FeS2+2HCl→ FeCl2+H2S↑+S↓ ②
2H2S+SO2→ 3S+2H2O ③
2NaOH+SO2→Na2SO3+H2O ④
Na2SO3+S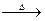 Na2S2O3 ⑤
Na2S2O3 ⑤
通过分析上述反应,进行计算:
(1)若在某密闭容器中加入150 g上述硫铁矿,并通入10 mol含氧气体积分数为0.4的富氧空气,按反应①充分反应后得到的气体中SO2的体积分数为__________(计算结果保留3位小数)。
(2)若以上各步反应的转化率均为100%,则150 g上述硫铁矿理论上最多可制得Na2S2O3___ g。
(3)若NaOH溶液吸收SO2的吸收率为90%,其它反应的转化率均为100%,则150 g上述硫铁矿最多可制得Na2S2O3多少g(写出计算过程,计算结果保留1位小数)?
(4)若反应②、④的转化率为90%,其它反应的转化率均为100%,要制得Na2S2O3最多,则原料中FeS2在反应①和②中的理论质量配比为多少(写出计算过程,计算结果保留3位小数)?
将25.0g胆矾(CuSO4·5H2O)溶于水配成200mL溶液,其密度为1.25g/cm3,试计算
(1)该溶液中CuSO4的质量分数为,SO42-的物质的量浓度为
(2)从该溶液中取出20mL加水稀释到100mL,稀释后的溶液中CuSO4的物质的量浓度为
(3)向稀释后的溶液中加入100mL1mol/L的NaOH溶液可生成沉淀的质量为此时溶液中的溶质是(填化学式)
(9分)将含有C、H、O的芳香族化合物3.24 g,装入元素分析装置,通入足量的O2使它完全燃烧,将生成的气体依次通过氯化钙干燥管A和碱石灰干燥管B。测得A管质量增加了2.16g,B管增加了9.24g。已知该有机物的相对分子质量为108。
⑴燃烧此化合物3.24g,须消耗氧气的质量是多少?
⑵求此化合物的分子式?⑶该化合物1H核磁共振谱上有5个信号峰,试写出符合的结构简式。
工业上铝土矿(含氧化铝、氧化铁等)制取铝的流程如下:
经分析,生产原料(铝土矿)经提取Al2O3后的残渣(赤泥)的部分成分见右表(以氧化物表示,Na2O由NaOH折算),且已知铝土矿中的Fe2O3全部转入赤泥。
| Al2O3 |
Fe2O3 |
Na2O |
|
| 铝土矿 |
55% |
16% |
0% |
| 赤泥 |
15% |
48% |
8% |
(1)生产中每消耗1 t铝土矿将产生吨赤泥。
(2)试计算每炼出1 t铝,理论上需要多少吨铝土矿?应补充多少吨NaOH?
已知Fe2O3在高炉中有下列反应:Fe2O3+CO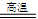 2FeO+CO2反应形成的固体混合物(Fe2O3·FeO)中,元素铁和氧的质量比用m(Fe)﹕m(O)表示。
2FeO+CO2反应形成的固体混合物(Fe2O3·FeO)中,元素铁和氧的质量比用m(Fe)﹕m(O)表示。
(1)上述固体混合物中,m(Fe)﹕m(O)不可能是。
A.21﹕9 B.21﹕7.5 C.21﹕6
(2)若m(Fe)﹕m(O)=21﹕8,计算Fe2O3被CO还原的百分率。
某化学课外小组用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
(1)写出生成硫酸铜的化学方程式。
(2)现用1㎏这种废铜屑理论上能制取胆矾多少千克?
(3)将胆矾与生石灰、水按质量比依次为1:0.56:100混合配制成无机铜杀菌剂波尔多液
①此波尔多液中Cu2+离子和Ca2+离子的物质的量比为(最简整数比)。
②波尔多液有效成分的化学式可表示为CuSO4·χCu(OH)2·уCa(OH)2,
此种配比当χ=1时,试确定у的数值。