A、T、X、Y、z是中学化学常见的四种元素,原子序数依次增大,其结构或性质信息如下表:
| 元素 |
结构或性质信息 |
| T |
基态原子的L层上s电子数等于p电子数 |
| X |
基态原子最外层未成对电子数在该元素所在周期中最多 |
| Y |
基态原子的第一电离能在该元素所在周期中最小 |
| Z |
单质常温、常压下是气体。基态原子的M层上有1个未成对的p电子 |
请根据信息回答有关问题(答题时如需表示具体元素,请用相应的元素符号):
(1)T、X、Z三种元素的电负性由大到小的顺序是 。
(2)写出与x单质分子互为等电子体的物质的化学式 、 。
(分子、离子各一种)
(3)元素Q的原子序数是Y与Z的原子序数之和。
①元素Q与元素T、x能形成平面型的[Q(TX)4]2-离子。TX-中T原子采用的轨道杂化方式是 。
②Q单质的晶胞如图所示,Q单质中Q原子的配位数为 。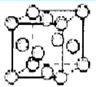

如下图所示,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色反应均为黄色。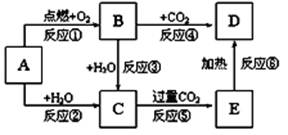
请填写下列空白:
(1)写出反应②的实验现象。
(2)以上反应中属于氧化还原反应的有。(填写编号)
(3) 反应②的化学方程式;
反应⑥的化学方程式。
向D中滴入HCl的化学方程式。
现有常见金属单质A、B 和气体甲、乙、丙及物质C、D,它们之间存在如下转化关系(图中有些反应的产物和反应的条件没有全部标出)。回答下列问题: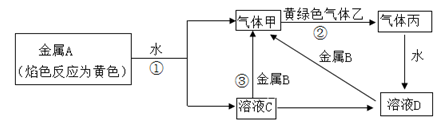
①写出金属B和气体甲的化学式:B,甲;
②黄绿色气体乙可以制漂白液和漂白粉,写出制漂白液的离子方程式
;漂白液的有效成分是。
0.5mol NH4Cl的质量是g,含有H原子mol,将此0.5mol NH4Cl与足量消石灰共热反应可制得NH3 L(标准状况下),用法收集产生的NH3,可用靠近集气瓶口,若则氨气已收集满。
实验室为了防止FeCl2溶液变质,通常向该溶液的试剂瓶中加入适量的粉,取适量FeCl2溶液于试管中,滴入适量的NaOH溶液产生色絮状沉淀,继而迅速的变为色,最后变为色的(写化学式)沉淀。
合金的硬度一般比它的各成分金属的,合金的熔点一般比它的各成分金属的,我国使用最早的合金是。