金属单质及其化合物与工农业生产、日常生活有密切的联系。请回答下列问题:
(2)一定温度下,氧化铁可以与一氧化碳发生如下反应: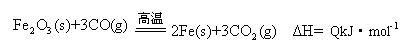
①该温度时,在2 L盛有Fe2O3粉末的密闭容器中通入CO气体,5 min后,生成了单质铁11.2 g,则这段时间内CO的反应速率为 ;
②达平衡后,若温度升高,的值增大,则Q 0(填“>”、“=”、“<”)。
(3)工业常根据金属氢氧化物在酸中溶解度不同,通过控制溶液的pH,达到分离金属离子的目的。如是难溶金属的氢氧化物在不同pH下的溶解情况(s/mol·L-1)。若要除去CuCl2溶液的少量Fe3+,应控制溶液的pH为 (填序号)。 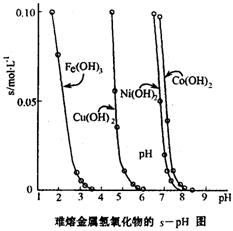
A.小于l B.4左右 C.大于6 D.大于9
(4)某工业废水中含有Cu2+、Pb2+、Hg2+,若向工业废水中加入过量的FeS,当FeS、CuS、PbS和HgS共存时,溶液中c(Fe2+):c(Pb2+):c(Hg2+)= : : 。
已知:Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(PbS)=3.4×10-28mol2·L-2
Ksp(CuS)=1.3×10-36mol2·L-2,Ksp(HgS)=6.4×10-53mol2·L-2
(5)依据氧化还原反应:Cu2+(aq)+Fe(s)===Fe2+(aq)+Cu(s)设计成如图所示的原电池,则关于该电池装置的说法中不正确的是 (填序号)。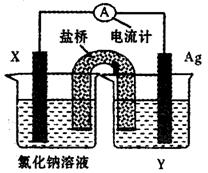
A.电极X的材料是Fe
B.电解质溶液Y是AgNO3溶液
C.原电池工作时,盐桥中的阴离子不断移向左池的氯化钠溶液中
D.原电池工作时,x电极反应为:O2+2H2O+4e-→4OH-
写出下列反应的离子反应方程式(全对得10分,有错即为0分)
(1)NaAlO2溶液中加入少量的盐酸
(2)AlCl3溶液中加入过量的NaOH
(3)Al2O3与NaOH水溶液的反应
(4)Fe3O4溶解在稀盐酸中
(5)FeCl2溶液中加入酸化的H2O2溶液
芳香化合物A、B互为同分异构体,B的结构简式如图所示,A经①、②两步反应得C、D和E。B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如图所示。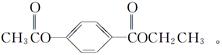
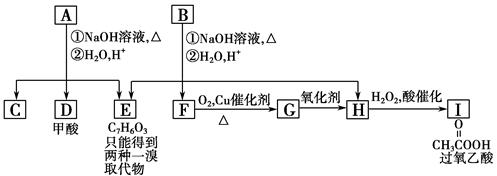
提示:①苯酚既具有酸性,又可与羧酸发生酯化反应。
②酯在NaOH加热的条件下可水解为对应的羧酸钠和醇。
R1COOR2 R1COONa+R2OH
R1COONa+R2OH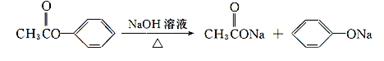
(1)写出E的结构简式____________________________________________________。
(2)A有2种可能的结构,写出相应的结构简式。__________________________________________。
(3)F和小粒金属钠反应的化学方程式是_______________ _______________
(4)写出F与H在加热和浓H2SO4催化作用下发生反应的化学方程式_ ________。反应类型是____________。
(5)写出F生成G的反应方程式____________________
(6)在B、C、D、F、G、I化合物中,互为同系物的是__________________。
(1)A(C4H6O2)的核磁共振氢谱有3种吸收峰,其峰面积之比满足3:2:1,A可与NaHCO3反应放出CO2,则A的结构简式为
(2)已知B(C10H12O)的结构满足以下条件①含有苯环,苯环上有两个取代基;②核磁共振氢谱显示有5种吸收峰③能发生银镜反应。请写出B的结构简式
(3)已知在柑橘、柠檬等水果中含有柠檬酸,且已知柠檬酸中只含C、H、O三种元素。
取柠檬酸19.2 g,在氧气中完全燃烧,产生CO2和H2O分别为26.4 g和7.2 g,现对该物质进行质谱分析,可获得柠檬酸的相对分子质量为192。利用红外光谱分析可知柠檬酸分子中含有—COOH和—OH。请回答:
①通过计算,可获得柠檬酸的分子式为____________。
②再利用核磁共振氢谱分析发现有4个吸收峰,其峰面积之比为4∶2∶1∶1。综合以上信息,写出柠檬酸的结构简式__________________________________。
③柠檬酸与有机物C在一定条件下发生酯化反应可生成一种相对分子质量为220的酯类物质。写出C可能的结构简式________________________________________________________。
(1)
用系统命名法命名烃A:______________;烃A的一氯代物具有不同沸点的产物有________种。
(2) 有机物的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
有机物的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
(3) 有机物的系统名称是__________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
有机物的系统名称是__________________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是____________。
在室温下,下列五种溶液:
①0.1mol/L NH4Cl
②0.1mol/L CH3COONH4
③0.1mol/L NH4HSO4
④0.1mol/L NH3·H2O和0.1mol/L NH4Cl的混合液
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是_______________________________(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是②③(填“>”“=”或“<”)。
(3)在溶液④中,离子的浓度为0.1mol/L;NH3·H2O和离子的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7, CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-)c(NH4+)(填“>”“=”或“<”)。