工业制取硫酸有一步重要反应是SO2在400~5000C下的催化氧化,2SO2+O2  2SO3 ,如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
2SO3 ,如果反应在密闭容器中进行,下述有关说法中错误的是 ( )
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%的转化为SO3 |
| C.若加入的为18O2,则一段时间后SO2、O2 、SO3中均含有18O |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
右图是一种航天器能量储存系统原理示意图。下列说法正确的是
| A.白天该系统中存在电能向化学能的转化 |
B.装置Y中负极的电极反应式为: |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.装置的X的阳极生成的产物是H2 |
下列装置所示的实验中,能达到实验目的的是
右图中a、b、c、d、e、f为元素周期表中前4周期的相邻的一部分元素,下列有关叙述正确的是
| a |
||||||||
| b |
c |
|||||||
| d |
e |
|||||||
| f |
|
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A. | 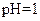 的溶液中:Fe 3+、 的溶液中:Fe 3+、 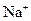 、 、 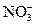 、Cl - 、Cl - |
| B. | 由水电离的c(H +)=1×10 -14mol/L的溶液中: 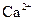 、 、 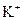 、 、 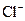 、 、 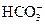 |
| C. | 加入铝粉能放出大量氢气的溶液中: 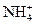 、 、 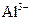 、 、 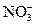 、 、 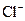 |
| D. | c(Fe 2+)=0.1mol/L的溶液中: 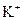 、 、 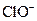 、 、 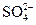 、 、 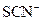 |
下列溶液中各微粒的浓度关系正确的是
| A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) |
| B.0.2mol/L的NaHSO4溶液中:c(Na+)>c(SO42-)> c(H+) > c(OH-) |
C.向NH4HCO3溶液中滴加NaOH溶液至中性:c(NH4+)+c(Na+)= c (HCO3-)+c(CO32-) (HCO3-)+c(CO32-) |
| D.0.1 mol/L pH=9的NaNO2溶液中:c(Na+)>c(NO2-)>c(OH-) >c(H+) |