可逆反应2NO2(g)  2NO(g) + O2(g),在体积不变的密闭容器中进行,达到平衡状态的标志是( )
2NO(g) + O2(g),在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时生成2n molNO2
②单位时间内生成n molO2的同时生成2n molNO
③NO2、NO、O2的物质的量浓度比值为2∶2∶1 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变 ⑥混合气体的总压强不再改变
| A.①④⑥ | B.②③⑤ | C.①③④ | D.全部 |
若一氧化碳和二氧化碳的混合气体的密度与同温同压下氧气的密度相同,则混合气体中一氧化碳和二氧化碳的物质的量之比是
| A.1∶3 | B.3∶1 | C.2∶1 | D.1∶2 |
要使含有Ag+、Cu2+、Mg2+、Ba2+等离子的溶液中的离子逐一形成沉淀析出,下列所选择试剂及加入试剂的顺序正确的是
| A.H2SO4→HCl→K2S→NaOH→CO2 | B.Na2SO4→NaCl→Na2S→NH3·H2O |
| C.NaCl→Na2SO4→H2S→NaOH | D.Na2S→Na2SO4→NaCl→NaOH |
M是一种治疗艾滋病的新药(结构简式见下图),已知M分子中—NH—COO—(除H外)与苯环在同一平面内,关于M的以下说法正确的是 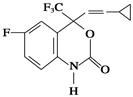
| A.该物质易溶于水 | B.M的分子式为C13H12O2NF4 |
| C.M能发生加聚反应 | D.M分子内至少有13个碳原子在同一平面内 |
所谓“绿色汽车”是指使用液化石油气作能源的汽车。绿色汽车可避免有毒的铅、苯的同系物以及稠环芳烃的排放。燃烧等质量的液化石油气(主要成分是含C3—C4的烷烃)与汽油(主要成分是含C5—C11的烷烃)相比较
| A.液化石油气生成的水少 | B.液化石油气消耗氧气量少 |
| C.液化石油气燃烧产生的热量少 | D.液化石油气产生的含碳化合物少 |
下列各组离子在指定溶液中能大量共存的是
①常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
②加入苯酚显紫色的溶液:K+、NH4+、Cl-、I-
③中性溶液:Fe3+、Al3+、NO3-、SO42-
④使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
⑤无色溶液中:K+、Al3+、NO3-、HCO3-
| A.① | B.①③ | C.②③ | D.①④⑤ |