短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):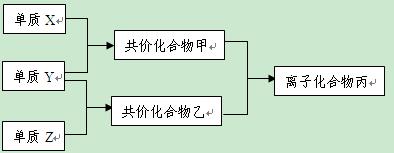
已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
⑴ X的电子式是 。
⑵ 实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
。
⑶ 磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
⑷ n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 。
某同学设计了如图所示装置进行石油分馏的实验。
(1)指出实验装置中仪器A、B、C、D的名称:
A________、B________、C________、D________。
(2)指出该同学所设计的实验装置中存在的错误,并给予改正。
错误:①_______________________________________;
②_____________________________________________。
改正:①_______________________________________;
②_____________________________________________。
(3)实验装置改正后,进行气密性检查的方法:______________________________。
(4)蒸馏烧瓶中放入几片碎瓷片的作用是__________________________________。
海藻中含有丰富的碘元素(以I-形式存在)。实验室中提取碘的流程如下: (1)实验操作③的名称是________,所用主要仪器名称为________。
(1)实验操作③的名称是________,所用主要仪器名称为________。
(2)提取碘的过程中,可供选择的有机试剂是________(填序号)。
A.酒精(沸点78℃) B.四氯化碳(沸点77℃)
C.甘油(沸点290℃) D.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl(ICl的性质类似于氯气),为消除此杂质,使碘全部游离出来,应加入适量(填序号)________溶液,反应的离子方程式______________________。
A.KIO3B.HClO C.KID.Br2
(4)利用碘的有机溶液得到单质I2的方法是_______________________________________。
实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取n g该种氨基酸放在纯氧气中充分燃烧,生成CO2、H2O和N2。现按图所示装置进行实验:
请回答下列有关问题:
(1)实验开始时,首先要通入一段时间的氧气,其理由是__________________________。
(2)以上装置中需要加热的仪器有________(用字母填空)。操作时应先点燃________处的酒精灯。
(3)A装置中发生反应的化学方程式是__________________________________________。
(4)装置D的作用是___________________________________。
(5)读取N2体积时,应注意:
①________________________________________________;
②________________________________________________。
(6)实验中测得N2的体积为V mL(已折算为标准状况)。为确定此氨基酸的分子式,还需要的有关数据有________(用字母填空)。
| A.生成CO2气体的质量 |
| B.生成H2O的质量 |
| C.通入O2的体积 |
| D.氨基酸的相对分子质量 |
某化学课外活动小组探究淀粉水解的条件,进行以下两个实验。
(1)实验用品:0.5 g淀粉、4 mL 20%硫酸溶液、氢氧化钠溶液、银氨溶液、碘水。
步骤:在试管1和试管2里各放入0.5 g淀粉,在试管1里加入4 mL 20%硫酸溶液,在试管2里加入4 mL水,都加热3~4 min。用过量碱液中和试管1里的硫酸溶液,把一部分液体倒入试管3。在试管2、3里都加入碘水,观察有没有蓝色出现。在试管1里加入银氨溶液,稍加热后,观察试管内壁上有无银镜出现。
根据所学知识预测可能的实验现象。
实验现象与结论(填入下表):
| 试管 |
加入碘水 |
加入银氨溶液 |
结论 |
| 1 |
|||
| 2 |
|||
| 3 |
(2)实验用品:0.5 g淀粉、唾液、新制氢氧化铜悬浊液。
步骤:在试管中加入0.5 g淀粉,加入少许唾液加热,在水解液中加入新制氢氧化铜悬浊液加热煮沸,观察现象。
现象:__________________________________________。
结论:__________________________________________。
(3)比较实验(1)(2)可得出的结论:___________________。
为了探究乙醇和金属钠反应的原理,做了如下四个实验:
实验一:向小烧杯中加入无水乙醇,再放入一小块金属钠,观察现象,并收集产生的气体。
实验二:设法检验实验一收集到的气体。
实验三:向试管中加入3 mL水,并加入一小块金属钠,观察现象。
实验四:向试管中加入3 mL乙醚(CH3CH2OCH2CH3),并加入一小块金属钠,发现无任何现象发生。
回答以下问题:
(1)简述实验二中检验气体的实验方法及作出判断的依据:
_____________________________________________________。
(2)从结构上分析,该实验选取水和乙醚做参照物的原因是
_____________________________________________________。
(3)实验三的目的是欲证明__________;实验四的目的是欲证明____________;根据实验三和实验四的结果,可以证明乙醇和金属钠反应的化学方程式应为________________________。