将1 mol H2(g)和2 mol I2 (g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+I2(g) 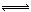 2HI(g);ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是 ( )
2HI(g);ΔH<0 ,并达到平衡。HI的体积分数ω(HI)随时间变化如图(Ⅰ)所示,若改变反应条件,ω(HI)的变化曲线如图(Ⅱ)所示,则改变的条件可能是 ( ) 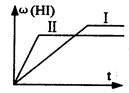
| A.恒温条件下,加入适当催化剂 | B.恒温,恒容下,充入氦气 |
| C.恒容条件下升高温度 | D.恒温,恒压下,充入氦气 |
下列有关研究化学反应原理的叙述中,正确的是
| A.研究化学反应中的能量变化,有利于通过改变反应条件,使同一反应消耗相同量的物质而放出更多的热,提高化学能的利用率 |
| B.任何放热的化学反应,均可以利用原电池直接把化学能转化为电能 |
| C.研究化学反应速率与化学平衡,有利于指导实际生产中达到“多,快,好,省”的生产效率 |
| D.使用催化剂常常可以加快化学反应速率,但不能提高反应物的转化率,因此在实际生产中较少使用催化剂 |
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
| A.用石墨作阳极,铁作阴极 |
| B.阳极的电极反应式为:Cl-+ 2OH--2e-= ClO-+ H2O[ |
| C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH- |
| D.除去CN-的反应:2CN-+ 5ClO-+2H+ =N2↑+2CO2↑+5Cl-+H2O |
下列叙述正确的是
| A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 |
| B.25℃时,等体积等浓度的硝酸与氨水混合后,溶液pH=7 |
| C.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
| D.0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) |
对于0.1mol·L-1的Na2S溶液,下列判断正确的是
| A.向溶液中加入少量NaOH固体,能促进水的电离 |
| B.c(Na+)=2c(S2-)+c(OH-)+c(HS-) |
| C.向Na2S溶液中加水稀释,其所有离子的浓度都减小 |
| D.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) |
如下8种物质中:①甲烷 ②聚乙烯 ③苯 ④氯乙烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯
⑧2-甲基-1,3-丁二烯,既能使酸性高锰酸钾溶液褪色,又能与溴水起加成反应使之褪色的是
| A.③④⑤⑧ | B.④⑤⑦⑧ | C.④⑤⑧ | D.③④⑤⑦⑧ |