已知:6.4克铜与适量的浓硝酸反应,当铜完全溶解后,共收集到NO和NO2混合气体共2.24升(已折算为标准状况)。
(1)写出有关反应的离子方程式 ;
。
(2)被还原的HNO3的物质的量为 ;
(3)参加反应的HNO3的物质的量为 。
超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO = 2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/(mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/(mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)在上述条件下反应能够自发进行,则反应的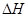 ______0(填写“>”、“<” 或“=”)。
______0(填写“>”、“<” 或“=”)。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)该反应的平衡常数K的表达式为K=_________________________;在该温度下,反应的平衡常数的值为____________
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是______
A. 选用更有效的催化剂 B. 升高反应体系的温度
C. 降低反应体系的温度 D. 缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面的实验设计表中。请在表格中填入剩余的实验条件数据。
| 实验编号 |
T/℃ |
NO初始浓度 mol·L-1 |
CO初始浓度 mol·L-1 |
催化剂的比表面积 m2·g-1 |
| Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| Ⅱ |
124 |
|||
| Ⅲ |
350 |
124 |
把煤作为燃料可通过下列两种途径:
途径I:直接燃烧:C(s)+O2(g) = CO2(g)
途径II:先制水煤气:C(s) + H2O(g) =" CO(g)" + H2(g)
燃烧水煤气:2 CO(g) + O2(g)=2CO2(g); 2H2(g)+O2(g) = 2H2O(g)
已知:①C(s)+O2(g) = CO2(g);△H1=-393.5kJ·mol-1
②H2(g) + 1/2 O2(g) = H2O(g);△H2=-241.8kJ·mol-1
③CO(g) + 1/2 O2 (g)= CO2(g);△H3=-283.0kJ·mol-1
请回答下列问题:
(1)C(煤)的标准燃烧热是
(2)根据盖斯定律写出煤和气态水生成水煤气的热化学方程式:
(3)在制水煤气反应里,反应物具有的总能量________(填“>”、“<”或“=”)生成物所具有的总能量。
(4)根据两种途径,下列说法错误的是 (单选)
| A.途径II制水煤气时增加能耗,故途径II的做法不可取 |
| B.与途径I相比,途径II可以减少对环境的污染 |
| C.与途径I相比,途径II可以提高煤的燃烧效率 |
| D.将煤转化为水煤气后,便于通过管道进行运输 |
把19.2 g 的Cu放入500mL 2 mol∙L−1稀硝酸中,充分反应,Cu完全溶解。求:
(1)写出Cu与稀硝酸反应的离子方程式:;
(2)铜完全溶解时转移电子数目为(用含NA的式子表示);
(3)氧化剂与还原剂的物质的量比为。
(4)反应后溶液中C(H+)为(体积变化忽略不计)
下表是元素周期表中一部分,表中所列的字母分别代表某一化学元素。根据表中所列元素回答下列问题。
| b |
|||||||||||||||||
| e |
g |
h |
|||||||||||||||
| a |
c |
f |
l |
||||||||||||||
| d |
|||||||||||||||||
(1)元素d是(填“金属元素”或“非金属元素”), 表中最活泼的金属元素符号是。
(2)表中能形成两性氢氧化物的元素是(用元素符号表示),写出该元素的单质与a最高价氧化物的水化物反应的化学方程式;写出该元素的氧化物与a最高价氧化物的水化物反应的离子方程式。
(3)a的最高价氧化物对应的水化物不能装在带磨口玻璃塞的试剂瓶,请用离子方程式说明其原因_________________。
有下列物质:氧气、浓硫酸、二氧化硫、硫化氢、铜片、钠、焦炭、氨气
请选择合适的物质填空,并回答有关问题:
(1)单质投入滴有酚酞的水中,有气体生成、溶液变红,请写出该反应的离子方程式:
(2)二氧化硫表现氧化性的实验,选择的试剂应是二氧化硫和
(3)能使酸性高锰酸钾溶液退色的酸性氧化物为
(4)两种物质间反应,生成的两种气体均能使澄清石灰水变浑浊,请写出该反应的化学方程式:
(5)发生催化氧化(制硝酸其中的一步)的化学方程式