T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是( )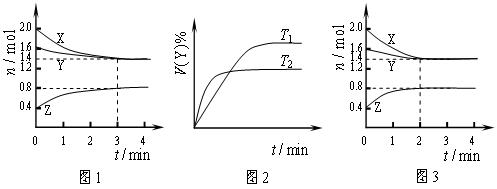
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.保持其他条件不变,升高温度,平衡逆向移动 |
| C.反应进行的前3min内,用X表示的反应速率 v(X)=0.1mol•L-1•min-1 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
在某一化学反应,0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为
| A.3mol/L | B.0.3mol/L•s | C.0.6mol/L•s | D.0.1mol/L•s |
现有①乙酸乙酯和乙酸钠溶液、②溴化钠溶液和溴水的混合液,分离它们的正确方法依次是
| A.分液、蒸馏 | B.萃取、分液 | C.分液、萃取 | D.蒸馏、分液 |
下列各分子中,所有原子都满足最外层为8电子结构的是
| A.H2O | B.BF3 | C.CCl4 | D.PCl5 |
X、Y、Z都是第三周期元素,核电荷数依次增大,X的氧化物对应水化物强碱,Z的原子半径最小。据此判断下列说法不正确的是
| A.X是第ⅠA元素,Z是第ⅦA元素 |
| B.X、Y、Z三种元素的最高化合价逐渐减小 |
| C.Z的最高价氧化物对应的水化物是强酸 |
| D.X、Z形成的化合物是离子化合物 |
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是
| A.C(s)+O2(g)=CO(g)△H=" ―393.5" kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)△H=" +571.6" kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=" ―890.3" kJ/mol |
| D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l)△H="―2800" kJ/mol |