有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是
| A.甲>乙>丙>丁 | B.丙>丁>乙>甲 |
| C.丙>丁>甲>乙 | D.丁>乙>甲>丙 |
纯碱和小苏打是厨房中两种常见的用品,它们都是白色固体。下列区分这种两种物质的方法正确的是
| A.分别用炒锅加热两种样品,全部分解挥发,没有物质残留的是小苏打 |
| B.先将两样品配成溶液,分别加入CaCl2,无白色沉淀生成的是小苏打 |
| C.两只小玻璃杯,分别加入少量两种样品,再加入等浓度等体积的食醋,产生气泡快的是小苏打 |
| D.先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
某同学用下列装置制备并检验Cl2的性质。下列说法错误的是
A.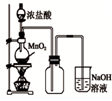 如图中: MnO2过量,盐酸能全部消耗 |
B.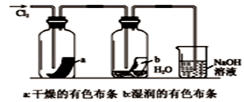 如图中:湿润的有色布条能褪色 |
C.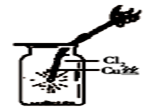 如图中:生成棕色的烟 |
D.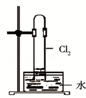 |
如图中:水可以充满试管
在一定温度下,向饱和烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原温度,下列说法错误的是
| A.溶液中Na+数目减少,有固体析出 |
| B.溶液中Na+数目减少,有气体逸出 |
| C.溶液中H2O数目减少,溶质的质量分数增大 |
| D.溶液中H2O数目减少,溶质的质量分数未变 |
利用N2→NH3→NO→NO2→HNO3这一过程制备HNO3,有关上述各物质的叙述不正确的是
| A.工业固氮的常用方法是N2和H2合成NH3 |
| B.可利用Cu与硝酸的反应,将N元素转化为NO或NO2 |
| C.为使上述各步骤依次发生,必须向每个步骤中提供氧化剂 |
| D.实验室可利用氢氧化钙固体与NH4Cl固体混合加热制备NH3 |
向下列各个反应产物的溶液中加入硫氰化钾试液,不会出现血红色的是
| A.Fe+Cl2(过量) |
| B.稀HNO3+Fe(少量) |
| C.FeCl2(过量)+Cl2 |
| D.Fe+浓盐酸(过量) |