下列各物质制取反应原理中,符合绿色化理念,原子利用率最高的是
| A.实验室用铜和浓硫酸反应制取硫酸铜 |
| B.实验室用铜和稀硝酸反应制取一氧化氮 |
| C.工业上利用乙烯与水的加成反应制取乙醇 |
| D.工业上用焦炭还原三氧化二铁制取铁 |
“绿色化学”提倡化工生产应尽可能将反应物的原子全部利用,从根本上解决环境污染问题。在下列制备环氧乙烷的反应中,最符合“绿色化学”思想的是 ( )
A.CH2=CH2+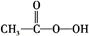 (过氧乙酸) (过氧乙酸)  +CH3COOH +CH3COOH |
B.CH2=CH2+Cl2+Ca(OH)2  +CaCl2+H2O +CaCl2+H2O |
C.2CH2=CH2+O2 2 2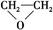 |
D.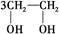   +HOCH2CH2—O—CH2CH2OH+2H2O +HOCH2CH2—O—CH2CH2OH+2H2O |
用下列实验装置进行的实验中,不能达到相应实验目的的是( )
| A.装置甲:气体从b口进入,收集CO2 | B.装置乙:可制得金属锰 |
| C.装置丙:实验室制取乙酸乙酯 | D.装置丁:验证HCl气体在水中的溶解性 |
探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 |
35 mL试剂 |
固体 |
混合前 温度/℃ |
混合后 温度/℃ |
| ① |
水 |
2.5 g NaHCO3 |
20.0 |
18.5 |
| ② |
水 |
3.2 g Na2CO3 |
20.0 |
24.3 |
| ③ |
盐酸 |
2.5 g NaHCO3 |
20.0 |
16.2 |
| ④ |
盐酸 |
3.2 g Na2CO3 |
20.0 |
25.1 |
由此得出的结论正确的是 ( )。
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0 ℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1 ℃
D.20.0 ℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2 ℃
科学家研制出了一种新型的贮氢材料——镁铝合金。这种镁铝合金具有特定的组成,其成分可表示为Mg17Al12。其贮氢和释氢的原理可表示为:Mg17Al12+17H2  17MgH2+12Al
17MgH2+12Al
下列有关说法正确的是( )
| A.该合金的熔点介于镁和铝的熔点之间 |
| B.Mg17Al12是离子化合物 |
| C.732g的合金能吸收380.8L氢气 |
| D.熔炼制备Mg17Al12时需通入氩气,目的是防止金属被氧化 |
为了说明影响化学反应快慢的因素,甲、乙、丙、丁4位同学分别设计了如下4个实验,你认为结论不正确的是( )
| A.将形状、大小均相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样 |
| B.在相同条件下,等质量的大理石块和大理石粉末与相同浓度的盐酸反应,大理石粉末反应快 |
| C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解 |
| D.两只试管中分别加入相同质量的氯酸钾,其中一只试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |