下面列出了几组物质,请将物质的合适组号填写在空格上。互为同位素的是 ,互为同分异构体的是 。
①金刚石与“足球烯”C60; ②D2O与T2O; ③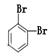 和
和
④CH4和CH3CH2CH3; ⑤葡萄糖与果糖; ⑥16O和18O
已知某白色混合物粉末中含有CuSO4、K2SO4、NH4HCO3、NH4Cl、NaCl五种物质中的两种,且物质的量之比为1:1。请完成下述探究混合物组成的实验。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、量筒、胶头滴管、药匙、酒精灯、火柴、试管夹、镊子;红色石蕊试纸、淀粉碘化钾试纸;1mol/L硫酸、1mol/L硝酸、1mol/L盐酸、1mol/L NaOH溶液、Ba(NO3)2溶液、AgNO3溶液、蒸馏水。
一、初步探究
取适量固体混合物于烧杯中,加入蒸馏水搅拌,混合物完全溶解,得到无色透明溶液A,同时闻到有轻微的刺激性气味。用胶头滴管取少量溶液A于试管中,再滴加稀硝酸,溶液中有无色气泡产生;继续滴加过量稀硝酸至溶液中不再产生气泡,得到无色透明溶液B。
(1)用(填实验用品名称)取固体混合物于烧杯中。
(2)上述实验可以得到的初步结论是。
二、进一步探究
(3)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
| 实验操作 |
预期现象和结论 |
某些化学反应可以表示为: A + B → C + D + H2O请回答下列问题:
(1)若A为红色的金属单质,B为第二周期某种元素的最高价氧化物的水化物,D在常温下可以转化为具有相同化合价的另一种氧化物E,则D和E分别为;
(2)若D分子的空间构型为三角锥形,C在实验室中常用作干燥剂,则A的晶体类型为、电子式为;
(3)若C、D均为气体且都能使澄清石灰水变浑浊,写出该反应的化学方程式;
(4)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:;
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素在周期表中的位置为 ;
(2)写出反应⑥的化学方程式 ;
(3)写出反应④的离子方程式 ;
(4)写出反应③阳极的电极反应式 ;
(5)反应①中每生成3molA,转移电子的物质的量为 。
减少SO2的排放、回收利用SO2成为世界性的研究课题。我国研究人员研制的利用低品位软锰矿浆(主要成分是MnO2)吸收废渣高温焙烧产生的SO2,制备硫酸锰的生产流程如下:
浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。
有关金属离子的半径以及形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
| 离子 |
离子半径(pm) |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
74 |
7.6 |
9.7 |
| Fe3+ |
64 |
2.7 |
3.7 |
| Al3+ |
50 |
3.8 |
4.7 |
| Mn2+ |
80 |
8.3 |
9.8 |
| Pb2+ |
121 |
8.0 |
8.8 |
| Ca2+ |
99 |
- |
- |
已知PbO2的氧化性大于MnO2。请回答下列问题:
⑴ 写出浸出过程中主要反应的化学方程式,氧化过程中主要反应的离子方程式。
⑵ 在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至。
⑶ 阳离子吸附剂用于除去杂质金属离子。决定阳离子吸附剂吸附效果的因素是(填写序号)。
a.溶液的pHb.金属离子的电荷c.金属离子的半径d.吸附时间
⑷ 操作a包括等过程。
空气质量高低直接影响着人类的生产和生活,它越来越受到人们的关注。被污染的空气中杂质的成分有多种,其中计入《空气质量日报》空气污染指数的项目有SO2、CO、NO2、O3和可吸入颗粒物等。
请回答下列问题:
⑴ S、N、O的第一电离能由大到小的顺序为。
⑵ 血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒。
① 写出亚铁离子的基态电子排布式。
② CO有多种等电子体,其中常见的两种为。
⑶ SO2是一种大气污染物,为减轻SO2污染,火力发电厂生产中常在
燃煤中加入CaO以“固硫”。 CaO晶胞如右图所示,其中Ca2+的配位
数为,CaO晶体和NaCl晶体中离子排列方式相同,其晶格能分
别为:CaO-3401kJ/mol、NaCl-786kJ/mol。CaO晶体的熔点NaCl
晶体的熔点(填“高于”、“等于”或“低于”)。
⑷ 随着人们生活质量的提高,不仅室外的环境安全为人们所重视,室内的环境安全和食品安全也越来
越为人们所关注。甲醛是室内主要空气污染物之一(其沸点是-19.5 ℃),甲醇是“假酒”中的主要
有害物质(其沸点是64.65 ℃),甲醇的沸点明显高于甲醛的主要原因是:。