银锌纽扣电池,其电池的电池反应式为Zn+ Ag2O+H2O =Zn(OH)2+2Ag。据此判断氧化银是 ( )
| A.负极,并被氧化 | B.正极,并被还原 |
| C.负极,并被还原 | D.正极,并被氧化 |
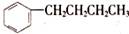 的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)
的同分异构体中,苯环上的一氯代物只有一种的结构有(不考虑立体异构)
| A.7种 | B.6种 | C.5种 | D.4种 |
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中,一定能大量共存的是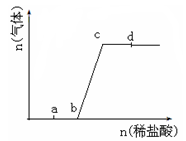
| A.a点对应的溶液中:Na+、OH-、SO42-、NO3-- |
| B.b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl- |
| C.c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D.d点对应的溶液中:F-、NO3-、Fe2+、Ag+ |
下列方法或操作正确且能达到预期目的的是
| 序号 |
实验目的 |
方法及操作 |
| ① |
比较水和乙醇中羟基氢的活泼性强弱 |
用金属钠分别与水和乙醇反应 |
| ② |
欲证明CH2=CHCHO中含有碳碳双键 |
滴入KMnO4酸性溶液,看紫红色是否褪去 |
| ③ |
证明蛋白质在某些无机盐溶液作用下发生变性 |
向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| ④ |
检验溴乙烷中的溴元素 |
将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液 |
| ⑤ |
判断不同反应的反应速率的大小 |
比较不同反应的反应热数据的大小 |
A.①③④B.②③④C.①②④D.②③⑤
近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、高锰酸钾溶液、次氯酸钠溶液、双氧水等消毒剂可以完全灭活病毒感染性。下列有关说法正确的是
| A.乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| B.高锰酸钾溶液和双氧水的消毒原理相同 |
| C.双氧水具有较强的腐蚀性,不能用于皮肤的消毒 |
| D.在次氯酸钠溶液中通入少量二氧化硫可得到亚硫酸钠和次氯酸 |
某溶液中含有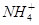 、Mg2+、Fe2+、Al3+、
、Mg2+、Fe2+、Al3+、 、
、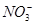 六种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,充分反应后溶液中大量减少的离子有
六种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,充分反应后溶液中大量减少的离子有
A.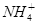 、Fe2+、 、Fe2+、 |
B.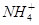 、 、 、 、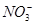 |
C.Mg2+、Fe2+、 |
D.Fe2+、Al3+、 |