下列化学用语的书写,正确的是
A.氮气的电子式: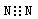 高考资源 高考资源 |
B.硫原子的结构示意图: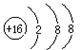 |
C.溴化钠的电子式: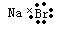 |
D.水分子的结构式: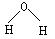 |
下列是某同学对KHSO4的物质类型进行的分析,其中不正确的是()
| A.根据元素组成知它是化合物 |
| B.因它含有钾与硫酸根,故KHSO4是钾盐 |
| C.KHSO4可以称为硫酸盐 |
| D.因为它含有与酸相同的元素氢,故KHSO4也可称为酸 |
2010年4月我国玉树发生地震灾害,假如你是卫生防疫人员,为配制0.01mol·L-1的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是()
| A.称量时,左盘高,右盘低 | B.定溶时俯视容量瓶刻度线 |
| C.原容量瓶洗净后为干燥 | D.摇匀后见液面下降,再加水至刻度线 |
下面三幅图中,与胶体有关的是()


①长江三角洲②东方明珠夜景③树林中的晨曦
| A.只有① | B.只有② | C.只有③ | D.全部 |
古诗词是古人为我们留下的宝贵精神财富。下列诗句中不涉及氧化还原反应的是()
| A.野火烧不尽,春分吹又生 | B.爆竹声中一岁除,春风送暖入屠苏 |
| C.春蚕到死丝方尽,蜡炬成灰泪始干 | D.粉身碎骨浑不怕,要留清白在人间 |
下列与化学学科关系不大的是()
| A.航空航天 | B.合成新药物 |
| C.食品成分检测 | D.组装空气压缩机 |