普通干电池的电极分别为碳棒和锌筒,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2吸收H2,ZnCl2吸收NH3),电极反应可简化为:Zn-2e-=Zn2+,2NH4++2e-= 2NH3+H2。根据以上所述判断下列结论不正确的是
| A.工作时Zn为负极,发生还原反应 |
| B.工作时电流由碳极经外电路流向Zn极 |
| C.输出电流时碳棒上发生还原反应 |
| D.长时间使用后内装糊状物可能流出,腐蚀用电器 |
在中学化学实验中可用来分离或提纯物质的方法很多,如蒸馏、过滤、结晶、渗析、盐析等,分离或提纯下列各组混合物所选用方法最合适的是( )
| A.FeCl3溶液得到FeCl3固体——加热蒸干 |
| B.除去Cu粉中混有的CuO——加入稀硝酸溶解、过滤、洗涤、干燥 |
| C.分离NaNO3和BaSO4的混合物——溶解、过滤 |
| D.除去NaOH溶液中混有的少量Na2SO4——加入BaCl2溶液、过滤 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A.0.1 mol·L-1 NaOH溶液:K+、Ba2+、Cl-、HCO3- |
| B.0.1 mol·L-1 Na2CO3溶液:K+、NH4+、NO3-、SO42- |
| C.0.1 mol·L-1 FeCl3溶液:K+、Na+、I-、SCN- |
| D.0.1 mol·L-1 HCl的溶液:Ca2+、Na+、ClO-、NO3- |
用试纸检验气体性质是一种重要的实验方法。如图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是( )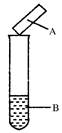
| 选项 |
试剂B |
湿润的试纸A |
现象 |
结论 |
| A |
碘水 |
淀粉试纸 |
变蓝 |
碘具有氧化性 |
| B |
浓氨水,生石灰 |
蓝色石蕊试纸 |
变红 |
氨气为碱性气体 |
| C |
Na2SO3,硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
| D |
Cu,浓硝酸 |
KI淀粉试纸 |
变蓝 |
NO2为酸性气体 |
设nA为阿伏加德罗常数的值。下列说法正确的是( )
| A.1L1mol·L-1的NaClO 溶液中含有ClO-的数目为nA |
| B.1mol的羟基与1 mol的氢氧根离子所含电子数均为9nA |
| C.标准状况下,22.4L盐酸含有nA个HCl分子 |
| D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2nA |
化学与社会、生产、生活紧切相关。下列说法正确的是( )
| A.煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B.用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约成本 |
| C.合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
| D.“地沟油”禁止食用,但可以用来制肥皂 |