25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A.2H+(aq) + (aq)+ (aq)+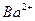 (aq)+2OH (aq)+2OH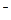 (aq)=BaSO4(s)+2H (aq)=BaSO4(s)+2H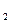 O(1); O(1);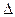 H= H=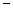 57.3 kJ/mol 57.3 kJ/mol |
B.KOH(aq)+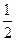 H H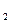 SO4(aq)= SO4(aq)= 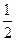 K K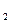 SO4(aq)+H SO4(aq)+H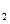 O(I); O(I);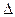 H= H=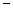 57.3kJ/mol 57.3kJ/mol |
C.C8H18(I)+ 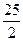 O O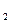 (g)=8CO (g)=8CO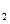 (g)+ 9H (g)+ 9H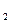 O; O;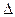 H= H=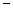 5518 kJ/mol 5518 kJ/mol |
D.2C8H18(g)+25O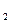 (g)=16CO (g)=16CO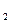 (g)+18H (g)+18H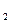 O(1); O(1);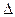 H= H=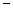 5518 kJ/mol 5518 kJ/mol |
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是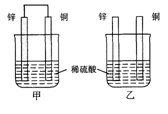
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
胶状液氢(主要成分是H2和CH4)有望用于未来的运载火箭和空间运输系统。实验测得:101kPa时,1mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量。下列热化学方程式书写正确的是
kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量。下列热化学方程式书写正确的是
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ·mol—1 |
| B.1/2CH4(g)+O2(g)=1/2CO2(g)+H2O(l);△H=-445.15kJ·mol—1 |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3kJ |
| D.2H2(g)+O2(g)=2H2O(l);△H=-285.8kJ·mol—1 |
下列变化属于吸热反应的是
①液态水气化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气 ⑤生石灰与水反应生成熟石灰⑥水煤气反应⑦二氧化碳与赤热的炭反应生成一氧化碳
⑤生石灰与水反应生成熟石灰⑥水煤气反应⑦二氧化碳与赤热的炭反应生成一氧化碳
| A.①④⑤⑦ | B.②③⑥ | C.①②④⑦ | D.②④⑥⑦ |
一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是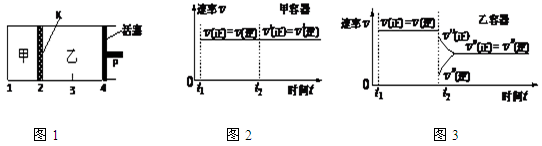
| A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度与乙中C的浓度相等 |
| B.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,甲、乙中B的体积分数均增大 |
| C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
在[Pb2+]为0.200mol/L的溶液中,若每升加入0.201mol的Na2SO4(设条件不变), 留在溶液中的Pb2+的百分率是(已知PbSO4的Ksp=1.8×10-8)
| A.1×10-3% | B.2×10-4% | C.9×10-3% | D.2.5×10-20% |