阿伏加德罗常数约为6.02×1023 mol—1,下列说法正确的是
| A.2.7g铝与足量的氢氧化钠溶液反应转移的电子数约是0.6×6.02×1023 |
| B.标准状况下,22.4升Cl2和H2的混合气经光照反应后,原子总数约为6.02×1023 |
| C.0.6 g CaCO3与Mg3N2的混合物中所含质子数为0.3×6.02×1023 |
| D.25℃时,1L pH=13的氢氧化钠溶液中含有的氢氧根离子数约为6.02×1023 |
一定温度下,在一个容积为1L的密闭容器中,充入1mol H2(g)和1mol I2(g),发生反应H2(g)+ I2(g)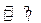 2HI(g),经充分反应达到平衡后,生成的HI(g)的气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1mol HI(g)发生反应HI(g)
2HI(g),经充分反应达到平衡后,生成的HI(g)的气体体积的50%,在该温度下,在另一个容积为2L的密闭容器中充入1mol HI(g)发生反应HI(g)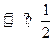 H2(g)+
H2(g)+ 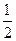 I2(g),则下列判断正确的是
I2(g),则下列判断正确的是
| A.后一反应的平衡常数为1 |
| B.后一反应的平衡常数为0.5 |
| C.后一反应达到平衡时,H2的平衡浓度为0.25mol·L-1 |
| D.后一反应达到平衡时,HI(g)的平衡浓度为0.5 mol·L-1 |
在温度、容积相同的3个密闭容器中,按不同方式投入 反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)===2NH3(g) △H="-92.4" kJ·mol-1)
反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知N2(g)+3H2(g)===2NH3(g) △H="-92.4" kJ·mol-1)
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1 mol N2、3 mol H2 |
2 mol NH3 |
4 mol NH3 |
| NH3的浓度(mol·L-1) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出a kJ |
吸收b kJ |
吸收 c kJ |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
| 反应物转化率 |
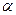 1 1 |
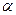 2 2 |
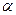 3 3 |
A.2c1>c3 B.a+b="92.4" C.2p2<p3 D.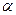 1+
1+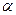 3>1
3>1
下列关于各配合物的稳定性,判断不正确的是
| A.[Fe(CN)6]3->[Fe(SCN)6] 3- | B.[HgCl4] 2-> [HgF4] 2- |
| C.[AlF6] 3->[AlBr6] 3- | D.[Cu(NH3) 4]2+>[Zn(NH3) 4]2+ |
朱经武(Paul Chu)教授等发现钇钡铜氧化合物在90K时即具有超导性,该化合物的部分结构如图产所示: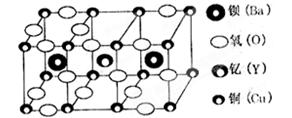
该化合物以Y2O3、BaCO3和CuO为原料,经研磨烧结而成,其原料配比(物质的量之比)为
| A.1:1:1 | B.1:4:6 | C.1:2:3 | D.2:2:3 |
现有四种元素的基态原子的电 子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5,则下列有关比较中正确的是
子排布式如下:①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5,则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |