碳正离子[例如,CH3+,CH5+,(CH3)3C+等]是有机反应中重要的中间体。欧拉(G.Olah)因在此领域研究中的卓越成就而获荣获1994年诺贝尔化学奖。碳正离子CH5+可以通过CH4在“超强酸”中再获得一个H+而得到;而CH5+失去H2,可以得到CH3+。
(1)CH3+是反应性很强的正离子,是缺电子的,其电子式是
(2)CH3+中4个原子时共平面,三个键角相等。键角应是___________
(3)(CH3)2CH+在NaOH的水溶液中反应将得到电中性的有机分子,其结构简式是 。
(4)(CH3)3C+去掉H+后将生成电中性的有机分子,其结构简式是 。
下表是元素周期表的一部分,按要求填空(填元素符号或化学式):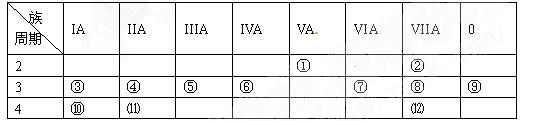
(1)写出下列元素的元素符号:①②
(2)在这些元素中,最活泼的金属元素是,最活泼的非金属元素是,最不活泼的元素是。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是,碱性最强的是 ,呈两性的氢氧化物是。
,呈两性的氢氧化物是。
(4)在③与④的单质中,化学性质较活泼的是,判断依据是;在⑧与⑿的单质中,化学性质较为活泼的是,判断依据是。
(5)⑾与⑿原子序数之差
(7分)A、B两种离子具有相同的电子层,A、B两元素的单质都能与水剧烈反应,在反应中A单质为氧化剂,B单质为还原剂。则:
(1)A离子的结构示意图为______________,B原子的结构示意图为______________。
(2)A元素位于______________周期______________族。新发现A的一种含氧酸的化学式为HAO,其中A的化合价为______________。
(3)A单质与水反应的化学方程式为___________ ___。
(4)B单质与水反应的离子方程式为____________ __。
(12分)(1)用电子式表示H2O和MgBr2的形成过程
H2O MgBr2
(2)写出CO2、Na2O2、H2O2的电子式:
CO2Na2O2H2O2
(3) H2O以键结合,MgBr2以键结合。NaOH以键结合,Na2O2以键结合(填极性键、非极性键、离子键)
(4)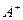 、
、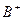 、
、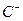 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①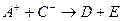 ;②
;②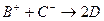 。
。 据此,回答下列问题:
据此,回答下列问题:
①写出①反应的离子方程式。
②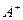 和C-的电子式
和C-的电子式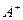 ____________、C-____________。
____________、C-____________。
X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物时,其电子式为,若XY2为共价化合物时,其形成过程的电子式为。
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等。据此填空:
| A |
C |
|
| B |
(1)A的氢化物分子式为,电子式为。
(2)B的元素符号为,原子结构示意图为,在周期表中位于第周期族;
(3)C的单质分子式为,C的单质溶于水所得溶液叫。