下列说法正确的是( )
| A.HF、HCl、HBr、HI的热稳定性依次减弱与它们的分子间作用力有关 |
| B.漂白粉、氢氧化铁胶体、盐酸、水玻璃、水泥都是混合物 |
| C.pH相等的CH3COOH、HCl和H2SO4三种溶液和等体积等物质的量浓度的NaOH反应恰好反应,消耗三种酸的体积:c(CH3COOH)<c(HCl)<c(H2SO4) |
| D.向0.1mol·L-1氯化铵溶液中加入水,氯化铵的水解程度增大,溶液酸性增强. |
在指定条件下能够大量共存的一组离子是()
| A.在pH=13的溶液中:Na+、Ba2+、Cl-、NO3- |
| B.使石蕊试液变红的溶液:Na+、ClO-、Cl-、NO3- |
| C.无色溶液: Cu2+、K+、SO42-、Cl- |
| D.强碱性溶液:K+、Mg2+、NO3-、HCO3- |
.已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,(MgF2的溶度积常数
Ksp=7.4×10-11)取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解
平衡,测得pH=13.0,则下列说法不正确的是()
A.所得溶液中的c(H+)=1.0×10-13mol·L-1
B .所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
D.298K时,饱和Mg(OH)2的溶液与饱和MgF2溶液相比前者的c(Mg2+)大
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)  2AB3(g)化
2AB3(g)化
学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),
根据如图可得出的判断结论正确的是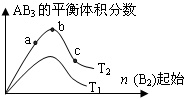

A.反应速率a>b>c |
B.达到平衡时,AB3的物质的量大小为:c>b>a  |
C.若T2<T1,则正反应一定是吸热反应 |
D.达到平衡时A2的转化率大小为:b>a>c |
下列溶液中有关物质的量浓度关系正确的是()
| A.在0.1mol/LNaHCO3溶液中: c(Na+)+c(H+)=c(  )+c(OH-) )+c(OH-) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合: c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中: c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D.在0.1mol/L的Na2CO3溶液中: |
c(Na+)>c( )>c(
)>c( )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是()
| A.加入适量的氯化铵晶体后,两溶液的pH均碱小 |
| B.温度下降10oC,两溶液的pH均不变 |
| C.分别加水稀释10倍,两溶液的pH仍相等 |
| D.用盐酸中和,消耗的盐酸体积相同 |