下图中每一个方格表示有关的一种反应物或生成物(部分的产物已省略),X加热产生A、B、C三种物质,其中A、C为无色气体,B在常温下是一种无色的液体,X与NaOH溶液在加热作用下产生一种能使湿润的红色石蕊试纸变蓝的气体C;X与HCl反应产生一种无色无味的气体A,它能使澄清石灰变浑浊,填下列空白:
(1)物质x可以是 或 ,C是 ,F是 。(填写化学式)
(2)B的化学键类型是 (填“极性键”或“非极性键”),空间构型是 ,分子的极性是 (填”极性分子”或”非极性分子”)
(3)由C制备D反应的化学方程式
(4)G的浓溶液与木炭反应的化学方程式
A、B、C、D、E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下:
请回答下列问题:
(1)A的分子式为;这五种化合物中,互为同分异构体的是(填序号)。
(2)若 ,且Y是D的同分异构体,写出反应①的化学方程式:,Y的结构简式为,反应③属于反应。
,且Y是D的同分异构体,写出反应①的化学方程式:,Y的结构简式为,反应③属于反应。
某化学兴趣小组设计了下图所示实验装置,其中c为石墨电极,d为银电极。
(1)甲池中OH-移向极(填电极的字母序号),f为(填电极名称)。
(2)a极上的电极反应式是。
(3)乙池中放出气体的电极为极(填“c”或“d”),写出此电极反应式:。
(4)乙池中总反应的离子方程式是。
(5)当乙池中阴极质量增加5.40 g时,丙池某电极析出1.60 g金属,则丙池的溶液中溶质可能是(填序号)。
| A.MgSO4 | B.CuSO4 | C.NaCl | D.AgNO3 |
某兴趣小组为研究原电池原理设计了如下图装置,盐桥中装有含琼胶的KCl饱和溶液。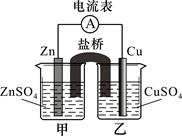
(1)Cu极为原电池的极(填“正”或“负”),电极反应式是;Zn极发生(填“氧化”或“还原”)反应。
(2)盐桥中K+移向(填“甲”或“乙”)烧杯的溶液。取出盐桥,电流计指针(填“偏转”或“不偏转”)。
(3)若将锌电极换为石墨,甲烧杯中盛装等物质的量浓度的Fe2(SO4)3和FeSO4混合溶液,则两烧杯中的电极反应式分别为:甲,乙。
铁矿石是重要的金属矿物资源,我省攀西地区有丰富的钒钛磁铁矿。
(1)在自然界中,钛(Ti)、钒(V)存在多种核素,其中 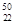 Ti与
Ti与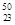 V相同的是。
V相同的是。
| A.质子数 | B.中子数 | C.质量数 | D.核外电子数 |
(2)通过下列方法可以测定磁铁矿中铁的含量:将磁铁矿溶于较浓的盐酸中,用SnCl2将Fe3+还原为Fe2+,最后用已知浓度的K2Cr2O7溶液滴定生成的Fe2+。
①磁铁矿中Fe3O4溶于盐酸时发生反应的离子方程式为。
② 配平K2Cr2O7溶液滴定FeCl2溶液时发生反应的离子方程式:
Fe2++Cr2O72-+H+==Fe3++Cr3++H2O
③现有磁铁矿样品0.500 g,经上述各步反应后,共用去0.0200 mol/L的K2Cr2O7溶液24.5 mL。计算该样品中铁的质量分数(计算结果保留1位小数)。
将11.2 L(标准状况)乙烯和乙烷的混合气体通入足量溴水中,充分反应后,溴水的质量增加了5.6 g。原气体混合物中乙烯与乙烷的物质的量之比为________。