在相同条件下,等质量(金属颗粒大小相当)的下列金属与足量1mol·L-1盐酸反应时,速率最快的是
| A.镁 | B.铝 | C.锌 | D.铁 |
砒霜中毒事件时有发生,砒霜的主要成分是三氧化二砷(As2O3),医生通常给砒霜中毒患者服用一定剂量的氧化剂解毒。下列有关叙述正确的是
| A.砷原子最外层有3个电子 | B.砷化氢(AsH3)比NH3稳定 |
| C.砷的+3价化合物有一定的还原性 | D.砷酸(H3AsO4)的酸性强于磷酸 |
鉴别NO2和溴蒸汽可用下列的
| A.湿润的淀粉碘化钾 | B.烧碱溶液 |
| C.硝酸银溶液 | D.湿润的蓝色石蕊试纸 |
在溶液中,反应A+2B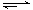 C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1c(B)="0.200" mol·L-1 c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1c(B)="0.200" mol·L-1 c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。
A.若反应①、②的平衡常数分别为K1、K2,则K1< K2
B.反应A+2B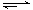 C的△H>0
C的△H>0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)="0.060" mol·L-1
有X、Y两种元素,原子序数≤20,X的 原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
| A.若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
| B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
| C.若X元素形成的单质是X2,则Y元素形成的单质不一定是Y2 |
| D.若Y的最高正价为+m,则X的最高正价一定为+m |
室温时,向pH=7的蒸馏水中加入一定量的NaHSO3晶体,保持温度不变,测得溶液的pH=4,下列说法正确的是
| A.水电离出的H+的浓度是1.0×10-4 mol·L-1 |
| B.溶液中离子浓度: c(HSO3-)>c(SO32-)>c(H2SO3) |
| C.溶液中离子浓度:c(Na+)=c(HSO3-)+2c(SO32-)+c(H2SO3) |
| D.溶液中离子浓度:c(H+)+c(HSO3-)+2c(H2SO3)=c(OH-) |