可逆反应达到“平衡状态”的重要特征是
| A.反应停止了 | B.正逆反应的速率均为零 |
| C.正逆反应都还在继续进行 | D.正逆反应的速率相等 |
已知X、Y、Z、W四种元素是元素周期表中三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的气态氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。下列说法正确的是
| A.X、Y、Z三种元素既能形成共价化合物也能形成离子化合物 |
| B.Y、Z、W三种元素形成的物质水溶液一定呈中性 |
| C.上述四种元素原子半径大小关系是W>Z>Y>X |
| D.W与Z形成的化合物一定是碱性氧化物 |
下列说法正确的是
| A.质谱法和核磁共振法不仅可用于有机小分子结构的分析,还可用于蛋白质结构的研究 |
| B.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 |
| C.气化、液化和干馏是煤综合利用的主要方法,这三者中只有干馏是化学变化 |
| D.蛋白质遇双缩脲试剂时会呈现紫玫瑰色,凡含有肽键的化合物均能发生该反应 |
用下列实验装置进行相应实验,能达到实验目的的是( )。
| 选项 |
A |
B |
C |
D |
| 装置 |
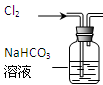 |
 |
 |
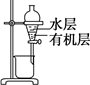 |
| 目的 |
除去Cl2中含有的少量HCl |
蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
制取少量纯净的CO2气体 |
分离CCl4萃取碘水后已分层的有机层和水层 |
相同温度下,将足量氯化银固体分别放入:①50mL蒸馏水 ②40mL 0.1 mol·L-1盐酸 ③20mL 0.1 mol·L-1氯化镁溶液 ④30mL0.1 mol·L-1硝酸银溶液中,Ag+浓度:
| A.①>④=②>③ | B.④>①>②>③ |
| C.④=②>①>③ | D.①>④>②③ |
已知某苯的同系物C8H10,苯环上有两个侧链,其一氯取代物的种数是
| A.10 | B.9 | C.6 | D.5 |