氯化碘(ICl)跟水发生反应:ICl+H2O=HIO+HCl,这个过程可以称为ICl的水解。预计PCl3水解的产物是
| A.PH3和HClO | B.HCl和H3PO4 | C.HCl和H3PO3 | D.HCl和HPO3 |
下列粒子只能作还原剂的是
①S②S2-③SO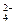 ④SO
④SO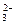 ⑤Cl-⑥Na
⑤Cl-⑥Na
| A.①②④ | B.②⑤⑥ |
| C.①⑤⑥ | D.②④⑤ |
常温下能用铁罐或铝罐贮存的是
| A.浓H2SO4 | B.浓HCl |
| C.稀H2SO4 | D.稀HCl |
24 mL浓度为0.05 mol·L-1的Na2SO3溶液,恰好与20 mL浓度为 0.02 mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应,则元素Cr在被还原产物中的化合价为
| A.+6价 | B.+3价 |
| C.+2价 | D.0价 |
已知氢氧化钙和碳酸钙在水中分别存在下列溶解平衡:Ca(OH)2(s) Ca2++2OH-,CaCO3(s)
Ca2++2OH-,CaCO3(s) Ca2++CO
Ca2++CO 。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
。在火力发电厂燃烧煤的废气中往往含有SO2、O2、N2、CO2等。为了除去有害气体SO2并变废为宝,常常用粉末状的碳酸钙或熟石灰的悬浊液洗涤废气,反应产物为石膏。
(1)写出上述两个反应的化学方程式:
①SO2与CaCO3悬浊液反应:________________________________________;
②SO2与Ca(OH)2悬浊液反应:____________________________________。
(2)试说明用熟石灰的悬浊液而不用澄清石灰水的理由。
(3)在英国进行的一项研究结果表明:高烟囱可以有效地降低地表面SO2浓度。在二十世纪的60~70年代的10年间,由发电厂排放的SO2增加了35%,但由于建造高烟囱的结果,地表面SO2浓度却降低了30%之多。
请你从全球环境保护的角度,分析这种方法是否可取?简述理由。
在一定温度下,向55 g水中加入一定质量的无水Na2SO3粉末,充分搅拌过滤,得到60 g溶液和一定质量的Na2SO3·7H2O晶体。若此温度下Na2SO3的溶解度为20 g,析出Na2SO3·7H2O晶体的质量为
| A.5 g | B.10 g |
| C.15 g | D.10.5 g |