如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物,它们之间有如图转化关系:
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质,X、Y、Z中只有一种是离子晶体,试推断:
①X的电子式是______________ _,若丙为灰黑色固体,则其晶体类型为_________________(填分子晶体,原子晶体,混合型晶体)。
②工业上有些气体中也含有一定量的Z成分,试列举一种气体______________。
③X与甲反应的化学方程式_________________________ _。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出甲、乙、丙三种物质的化学式甲________ ____、乙__________ __、丙________ ____。
②写出X与足量的甲在溶液中完全反应的离子方程式: 。
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式A ____________________ B _______________________
(2)实验室提纯粗盐的实验操作依次为:
取样、_______、沉淀、_______、_______、冷却结晶、_______、烘干
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是__________________________
碳酸化时没有析出碳酸钠晶体,其原因是____________________________________
(4)碳酸化后过滤,滤液D最主要的成分是__________________________(填写化学式),检验这一成分的阴离子的具体方法是:___________________________________
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:__________________________________________滤液D加石灰水前先要加热,原因是___________________________________________
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:____________________________
(注明你的表达式中所用的有关符号的含义)
有A、B、C、D、E、F六种元素,已知:它们位于三个不同的短周期,核电荷数依次增大;A与E、B与F分别同主族;A、E分别都能与D按原子个数1∶1或2∶1 形成化合物;B、C分别能与D按原子个数1∶1或1∶2形成化合物
形成化合物;B、C分别能与D按原子个数1∶1或1∶2形成化合物
(1)写出只含有A、B、D、E四种元素的两种无结晶水盐的化学式、。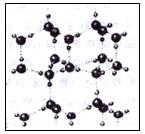
(2)如图是A与D形成的一种化合物的晶体结构示意图,其中的虚线表示 。E与D按原子个数比1∶1形成的化合物的电子式为。
。E与D按原子个数比1∶1形成的化合物的电子式为。
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下表列出了上述部分元素形成的化学键的键能:
| 化学键 |
F—D |
F—F |
B—B |
F—B |
B==D |
D==D |
| 键能/ kJ·mol−1 |
460 |
176 |
347.7 |
347 |
745 |
497.3 |
① 下列三种物质形成的晶体,熔点由高到低的顺序为(用a、b、c表示)。
a.F与B形成的化合物 b.B与D形成的稳定化合物 c.F的单质
② 试写出F单质晶体的燃烧的热化学方程式:。
仔细体会下列有机合成过程中碳骨架的构建及官能团的引入和转化,完成下题:肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的: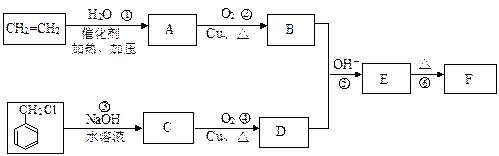
已知:反应⑤为加成反应。请回答:
(1)肉桂醛F的结构简式为:。E中含氧官能团的名称为。
(2)反应①~⑥中符合原子经济性的是。
(3)写出下列转化的化学方程式:
②,
③。
写出有关反应的类型:②⑥。
(4)符合下列要求的E物质的同分异构体有种(苯环上有两个取代基,其中
有一个甲基在对 位且属于酯类)。
位且属于酯类)。
有A、B、C、D四种化合物,分别由Ba2+、K+、SO42-、OH-、CO32-、SO32-中的两种所组成,它们各具有下列性质:①A既不溶于水,又不溶于盐酸,②B不溶于水,但可溶于盐酸并放出无色无味气体;③C的水溶液呈碱性,与稀硫酸反应生成A④D溶于水,与硫酸作用时放出的气体E可使溴水褪色。
(1)推断A、B、C、 D、E各为何种物质,写出它们的化学式。
D、E各为何种物质,写出它们的化学式。
A:,B:,C:,D:,E:。
(2)写出下列离子方程式:
B与盐酸反应;
C与硫酸反应;
D与硫酸反应;
E与溴水反应。
下表是元素周期表的一部分,用元素符号或化学式回答下列问题:
| 主族周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
① |
|||||||
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)在这些元素中_______是最活泼的金属元素;其氢氧化物具有两性的元素是
(2)这些元素的最高价氧化物对应的水化物中酸性最强的物质的化学式_________
(3)从⑤到⑩元素中_______原子半径最小。
(4)最不活泼的元素的单质的化学式是。若该元素某核素原子核内中子数与质子数相等,则该核素的摩尔质量是
(5)用电子式表示⑩、⑥两元素形成化合物的过程
(6)与元素⑨非金属性强弱最接近的元素是
(7)根据下表判断:最接近磷原子半径R(10-10m)的取值范围的是
| 元素 |
N |
S |
O |
Si |
| 原子半径/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |