下列制取氯乙烯的生产工艺中,比较符合“全合成、零排放、无污染”的绿色化学思想的是
A.乙炔氢氯化法: |
B.乙烯直接氯化法: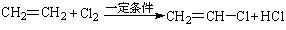 |
C.乙烯氯化裂解法: |
D.乙烯氯化平衡法: |
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)
2HBr(g) 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
| A.a>b | B.a="b" | C.a<b | D.无法确定 |
若NA表示阿伏加德罗常数的值,下列叙述正确的是
①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的原子数为2 a NA /22.4
③电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
④7 g CnH2n中含有的氢原子数为2NA
⑤常温常压下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
⑥1 L 2 mol·L-1 FeCl3溶液中含Fe3+数为2NA
⑦2 L1 mol·L-1的盐酸中所含氯化氢分子数为2NA
| A.①④⑦ | B.②⑥ | C.③④⑤ | D.②⑤ |
将0.10mol·L-1的盐酸逐滴加入0.10mol·L-1的氨水,滴加过程中不可能出现的结果是
| A.c(NH4+)>c(Cl-),c(OH-)>c(H+) | B.c(NH4+)=c(Cl-),c(OH-)=c(H+) |
| C.c(Cl-)>c(NH4+),c(OH-)>c(H+) | D.c(Cl-)>c(NH4+),c(H+)>c(OH-) |
已知:断裂下列化学键需要吸收的能量分别为:
H-H 436 kJ/mol;F—F 153 kJ/mol;H—F 565 kJ/mol。
下列说法正确的是
| A.H2与F2反应的热化学方程式为:H2(g) + F2(g) = 2HF(g)△H =" -541" kJ |
| B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
关于下列各图的叙述,正确的是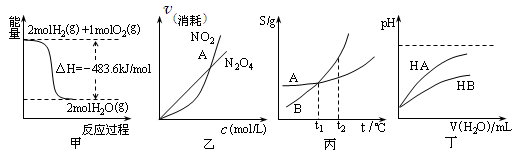
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温
至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液