室温下,1 L某溶液中含有的离子如下表:(不考虑水解)
| 离子 |
Cu2+ |
Al3+ |
NO3- |
Cl- |
| 物质的量浓度(mol/L) |
1 |
1 |
4 |
a |
用惰性电极电解该溶液,当电路中有3 mol e―通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是( )
| A.电解后溶液的pH=0 | B.阳极与阴极析出的气体物质的量之比为1:2 |
| C.阳极电极反应只有:2Cl-—2e-=Cl2↑ | D.阴极析出32g铜 |
从下列事实所得出的解释或结论正确的是
| 选项 |
实验事实 |
解释或结论 |
| A |
2N2O5(g)=4NO2(g)+O2(g) ΔH>0 在室温下能自发进行 |
这是一个熵增的反应 |
| B |
压缩针筒内的NO2和N2O4混合气体,颜色先变深后变浅 |
增大压强,平衡向生成N2O4的方向移动,新平衡比旧平衡压强小 |
| C |
锌与稀硫酸反应过程中,开始反应后,速率逐渐增大 |
该反应是吸热反应 |
| D |
已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 |
反应物的浓度一定降低 |
对于可逆反应A(g)+2B(g) 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是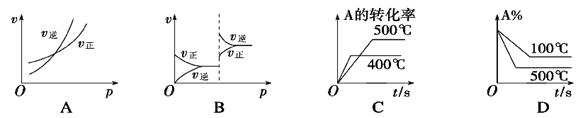
在恒温、恒容条件下,能使A(g)+B(g)  C(g)+D(g)正反应速率增大的措施是
C(g)+D(g)正反应速率增大的措施是
| A.减小C或D的浓度 | B.增大D的浓度 |
| C.减小B的浓度 | D.增大A或B的浓度 |
在恒温、恒容的容器中进行反应:2HI H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为
| A.等于10 s | B.等于12 s | C.大于12 s | D.小于12 s |
下列关于平衡常数K的说法中,正确的是
| A.在任何条件下,化学平衡常数是一个恒定值 |
| B.改变反应物浓度或生成物浓度都会改变平衡常数K |
| C.平衡常数K只与温度有关,与反应浓度、压强无关 |
| D.从平衡常数K的大小不能推断一个反应进行的程度 |