某市进行学业水平考试实验操作考查,试题分别为:
Ⅰ.试验维生素C的化学性质(主要是还原性)。
Ⅱ.葡萄糖与新制氢氧化铜的反应。
Ⅲ.配制一定物质的量浓度的氯化钠溶液。
⑴试题中设置了“评价与反思”,下列“评价与反思”不合理的是: 。(填序号)
| A.应该由监考老师去评价与反思 |
| B.实验结论告诉我:维生素C丸子应该密封保存 |
| C.维生素C能使淀粉的碘溶液褪色 |
| D.配制新制氢氧化铜时要将氢氧化钠与硫酸铜溶液等物质的量混合 |
E.实验Ⅲ中玻璃棒的作用是搅拌和引流
F.实验Ⅱ中的废水应该回收后再集中处理,不能直接倒入下水道
⑵实验Ⅲ中合理的实验操作顺序是:④ 。(填序号)
①溶解,②计算和称量,③转移和洗涤,④查漏,⑤定容和摇匀。
⑶实验Ⅱ考查结束后,发现试管内壁附着一层红色固体。为了洗干净试管,某学习小组尝试往试管中加适量(3mL)稀硝酸,发现红色固体立即消失,溶液呈蓝色,则该反应的离子方程式为: 。
某化学小组在学习元素周期律知识后,对教材中Cl2将Fe2+氧化成Fe3+的实验进一步思考,并提出问题:Cl2能将Fe2+氧化成Fe3+,那么Br2和I2能否将Fe2+氧化成Fe3+?
环节一:理论推测。
部分同学认为Br2和I2都能将Fe2+氧化成Fe3+,依据是____________________
_________________________________________________________________。
部分同学认为Br2和I2都不能将Fe2+氧化成Fe3+。还有同学认为Br2能将
Fe2+氧化成Fe3+,而I2不能,依据是同一主族从上到下卤素单质的氧化性逐渐减弱。
环节二:设计实验进行验证。
向大试管中加入适量铁粉,加入10 mL稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验。
实验1:
| 试管 |
操作 |
现象 |
| ① |
先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量红棕色的溴水,振荡试管 |
溶液为 黄色 |
| ② |
先向试管中加入2 mL新制的FeCl2溶液,再向试管中滴加少量棕黄色的碘水,振荡试管 |
溶液为 黄色 |
环节三:实验现象的分析与解释。
(1)甲同学认为试管①中的现象说明溴水能将Fe2+氧化,反应的离子方程式为_________________________________________________________________。
乙同学认为应该补做实验,才能得出甲同学的结论。请你帮助乙同学完成实验:
实验2:
| 操作 |
现象 |
(2)该小组同学对试管②中所得的溶液呈黄色的原因展开讨论,并提出了两种假设:
假设1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色。
假设2.________________。
实验3:进行实验以判断假设是否成立。
| 操作 |
现象 |
| 向试管②所得的溶液中继续加入0.5 mL CCl4,充分振荡,静置一段时间。取出上层溶液,滴加KSCN溶液 |
静置后,上层溶液几乎无色,下层溶液为紫色;取上层溶液滴加KSCN溶液后,溶液呈浅红色 |
丙同学认为实验3的现象可以说明假设2成立,丁同学认为不严谨,于是设计了实验4继续探究。
实验4:
| 操作 |
现象 |
| 向另一支试管中加入2 mL新制的FeCl2溶液,滴加0.5 mL碘水后,再加入0.5 mL乙酸乙酯,充分振荡,静置一段时间。取出下层溶液,滴加KSCN溶液 |
静置后,上层溶液为紫色,下层溶液几乎无色;取下层溶液,向其中滴加KSCN溶液后,溶液没有呈浅红色 |
你认为实验4中加入乙酸乙酯的主要目的是___________________________。
丁同学根据实验4的现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小。
(3)Cl2、Br2、I2氧化Fe2+的能力逐渐减弱,从原子结构角度解释原因:______________________________________________________________________。
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是______________________________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):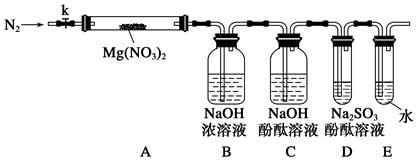
(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明__________。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是________;关闭k,用酒精灯加热时,正确操作是先________,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______________(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是_____________________________________。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
某课外活动兴趣小组欲用下列化学试剂在实验室里制取Cl2并验证Cl2的某些化学性质。实验试剂:3 mol·L-1 H2SO4、1 mol·L-1 NaOH溶液、MnO2、KMnO4、吸收少量SO2的NaOH溶液、浓盐酸、紫色石蕊试液、饱和NaCl溶液、BaCl2溶液、品红溶液。甲小组设计的实验装置图如下,在B中加入吸收少量SO2的NaOH溶液,D中加入1 mol·L-1 NaOH溶液。请回答下列问题:
Ⅰ.(1)写出仪器X的名称:________。
(2)写出A中发生反应的化学方程式:__________________________________,
不能用E装置代替A装置的原因是___________________________________。
(3)C装置的作用是_________________________________________________。
(4)甲小组通过该实验要验证Cl2的________(填“漂白性”、“还原性”或“氧化性”)。
(5)乙小组认为甲小组设计的实验装置有缺陷,请你帮助甲小组完善该装置。即还要在________和________(填“A”、“B”、“C”或“D”)装置间连接一个装有________的洗气装置。
Ⅱ.丙小组认为反应一段时间后,B装置溶液(强碱性)中肯定存在Cl-、OH-和SO,可能还含有其他的阴离子。
请你设计实验帮助丙小组探究该吸收液中可能存在的其他阴离子。
(1)提出合理假设
假设1:只存在________,或只存在________。
假设2:可能两者都________(填“存在”或“不存在”)。
(2)请设计实验验证假设的正确性:___________________________________。
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示: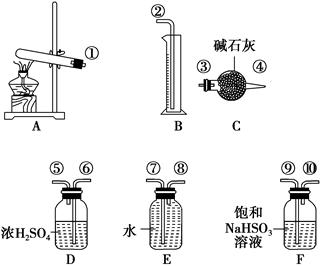
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验 小组 |
称取CuSO4 的质量/g |
装置C增加 的质量/g |
量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 |
6.4 |
2.56 |
448 |
| 二 |
6.4 |
2.56 |
224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:________________________________________________________;
第二小组:________________________________________________________。
某研究小组用如图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释,这样操作的目的是________,操作中不需要的仪器有________(填入正确选项前的字母)。
a.药匙 b.烧杯 c.石棉网 d.玻璃棒 e.坩埚
(2)通入足量SO2时,C中观察到的现象为______________________________。
(3)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向C试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法________(填“合理”或“不合理”),理由是_______________________________________________________________。
(4)D装置中倒置漏斗的作用是______________________________________。
(5)为了验证SO2具有还原性,实验中可以代替FeCl3的试剂有________(填入正确选项前的字母)。
a.浓H2SO4b.酸性KMnO4溶液
c.碘水d.NaCl溶液