下列离子方程式不正确的是
| A.SO2通入Ca(ClO)2溶液中:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| B.在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解: 3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O |
| C.碳酸钠溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- |
| D.氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O |
设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
A.常温下,0.1 mol碳酸钠晶体中含有C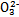 的个数为0.1NA 的个数为0.1NA |
| B.标准状况下22.4 L H2O所含分子数为NA |
| C.1 L 0.5 mol·L-1 CH3COOH溶液中,CH3COO-的个数为0.5NA |
| D.在NO、NO2的混合气体22.4 L中,含有的氮原子数为NA个 |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 |
Na2CO3 |
NaHCO3 |
NaClO |
NaHSO3 |
| pH |
11.6 |
9.7 |
10.3 |
5.2 |
下列说法中正确的是( )
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS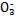 )>c(S
)>c(S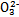 )>c(OH-)
)>c(OH-)
向20 mL 0.5 mol·L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是( )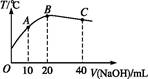
| A.醋酸的电离平衡常数:B点>A点 |
| B.由水电离出的c(OH-):B点>C点 |
| C.从A点到B点,混合溶液中可能存在:c(CH3COO-)=c(Na+) |
| D.从B点到C点,混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是( )
H++OH-,下列叙述中正确的是( )
| A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性 |
| B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小 |
| C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡 |
| D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变 |
工业上常用还原沉淀法处理含铬废水(Cr2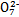 和Cr
和Cr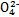 ),其流程为:Cr
),其流程为:Cr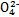
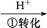 Cr2
Cr2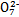
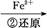 Cr3+
Cr3+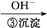 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr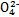 (黄色)+2H+
(黄色)+2H+ Cr2
Cr2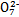 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是( )
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr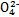 浓度增大 浓度增大 |
B.步骤①中当2v(Cr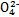 )=v(Cr2 )=v(Cr2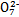 )时,说明反应2Cr )时,说明反应2Cr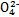 (黄色)+2H+ (黄色)+2H+ Cr2 Cr2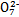 (橙色)+H2O达到平衡状态 (橙色)+H2O达到平衡状态 |
C.步骤②中,若要还原1 mol Cr2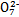 ,需要12 mol (NH4)2Fe(SO4)2·6H2O ,需要12 mol (NH4)2Fe(SO4)2·6H2O |
| D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽 |