只用一种试剂就能将甲苯、苯酚、己烯、四氯化碳、碘化钾溶液区分开来,这种试剂是:
| A.溴水 | B.溴化钾溶液 | C.硝酸银溶液 | D.酸性KMnO4溶液 |
有①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液各25mL,物质的量浓度均为0.1 mol/L,下列说法正确的是()
| A.3种溶液pH的大小顺序是③>②>① |
| B.若将3种溶液稀释相同倍数,pH变化最大的是② |
| C.若分别加入25mL0.lmol/L盐酸后,pH最大的是① |
| D.若用Pt电极电解3种溶液一段时间后,pH均不变 |
下列有关说法正确的是()
| A.反应NH3(g)+HCl(g)= NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.CH3COOH溶液加水稀释后,电离平衡正向移动,溶液中的c(CH3COO-)增大 |
| D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是()
4NO(g)+ 6H2O(g),下列叙述正确的是()
| A.达到化学平衡时,4υ正(O2)= 5υ逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O) |
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ·mol-1
②Fe2O3(s)+ CO(g)=
CO(g)=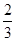 Fe3O4(s)+
Fe3O4(s)+ CO2(g)ΔH=-15.73kJ·mol-1
CO2(g)ΔH=-15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ·mol-1
则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
| A.-218kJ·mol-1 | B.-109kJ·mol-1 |
| C.+218kJ·mol-1 | D.+109kJ·mol-1 |
如下图各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )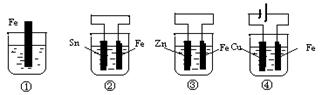
| A.④>②>①>③ | B.②>①>③>④ |
| C.④>②>③>① | D.③>②>④>① |