将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )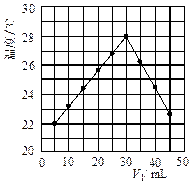
| A.做该实验时环境温度为22 ℃ | B.该实验表明化学能可以转化为热能 |
| C.NaOH溶液的浓度约是1.00 mol/L | D.该实验表明有水生成的反应都是放热反应 |
下列说法正确的是
A. 的名称为2,2,4-三甲基-4-戊烯 的名称为2,2,4-三甲基-4-戊烯 |
B.化合物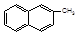 不是苯的同系物 不是苯的同系物 |
C. 分子中所有碳原子一定共平面 分子中所有碳原子一定共平面 |
| D.除甲酸外的羧酸均不能使酸性高锰酸钾溶液褪色 |
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
| A.K+、Na+、Br—、SiO32— | B.H+、Fe2+、SO42—、Cl2 |
| C.K+、Ba2+、Cl—、NO3— | D.K+、Ag+、NH3·H2O、NO3— |
依据元素周期表及元素周期律,下列推断正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.若M+和R2-的核外电子层结构相同,则原子序数:R>M |
| D.主族元素的最高正化合价等于该元素原子的最外层电子数 |
下列说法正确的是
| A.在Ba(OH)2溶液中,c(Ba2+)=2c(OH-) |
| B.蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| C.煤的气化和液化均属于化学变化 |
| D.强电解质和弱电解质的划分依据是电解质水溶液的导电能力强弱 |
下列化学用语正确的是
| A.钙离子的电子式:Ca2+ | B.HCl的电子式: 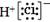 |
C.中子数为20的氯原子: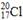 |
D.O的原子结构示意图: |