下列反应的离子方程式书写正确的是
A.铝与稀硝酸反应:2Al + 6H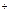  2Al 2Al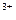 + 3H2↑ + 3H2↑ |
B.MnO2与浓盐酸共热制取Cl2:MnO2 + 4H+ + 2Cl- Mn2++ Cl2↑+ 2H2O Mn2++ Cl2↑+ 2H2O |
C.氯气与水反应:Cl2 + H2O 2H 2H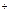 + Cl + Cl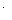 +ClO +ClO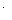 |
D.氢氧化钠溶液吸收SO2气体:2OH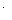 + SO2 + SO2 SO SO + H2O + H2O |
氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3—+3HSO3—==3SO42—+Cl—+3H+
已知该反应的速率随c(H+)的增大而加快。下列为用ClO3—在单位时间内物质的量浓度变化表示的该反应v-t图。下列说法中不正确的是(C )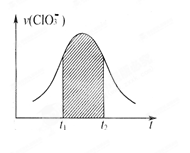
| A.反应开始时速率增大可能是c(H+)所致 |
| B.纵坐标为v(Cl—)的v-t曲线与图中曲线完全重合 |
| C.纵坐标为v(H+)的v-t曲线与图中曲线完全重合 |
| D.后期反应速率下降的主要原因是反应物浓度减小 |
近年来用红外激光技术研究液氢时,发现分子间作用力也可引起微粒间的反应,在液氢中氢分子和质子形成的H3+离子,其构型是等边三角形,属于二电子三中心离子,同时H3+还可进一步形成Hn+,下列判断不正确的是( B )
A.H3+的电子式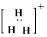 |
| B.H3+可在液氢中形成H4+、H5+、H6+ |
| C.H3+可在液氢中形成H5+、H7+、H9+ |
| D.每个H3+微粒中含有3个质子 |
铅蓄电池的两极分别是Pb、PbO2,电解质溶液为30%硫酸,工作时反应为:
Pb+PbO2+2H2SO4 2PbSO4+2H2O下列结论正确的是(B)
2PbSO4+2H2O下列结论正确的是(B)
| A.PbO2为正极,被氧化 | B.电池电解质溶液的密度不断减小 |
| C.c(H+)逐渐增大 | D.H+向负极移动 |
下列分子中所有的原子都满足最外层为8电子结构的是(B )
| A.BCl3 | B.COCl2 | C.SF6 | D.SiH4 |
关于化学键的叙述中,正确的是(C )
| A.HCl电离产生H+和Cl—,可判断HCl分子中存在离子键 |
| B.Na2O2固体中含有的阴离子与阳离子的个数比为1:1 |
| C.化学键是指使原子或离子相互结合的作用力 |
| D.不同元素组成的多原子分子中的化学键一定全是极性键 |