下列各组原子序数表示的两种元素能够形成共价化合物的是
| A.11与17 | B.13与10 | C.12与8 | D.8与16 |
下列说法正确的是
| A.反应:2CO(g)+2NO(g) |
| B.0.1mol/L NH4C1溶液加蒸馏水稀释,溶液的pH不断减小 |
| C.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭 |
D.反应:2A(g) B(g)+2C(g),增大压强反应速率加快,A的转化率减小 B(g)+2C(g),增大压强反应速率加快,A的转化率减小 |
下列离子方程式表达不正确的是
A.用SO2水溶液吸收Br2:SO2 + Br2+2H2O =4H+ + SO +2Br- +2Br- |
| B.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3===2Cu2++CO2↑+3H2O |
C.酸性高锰酸钾和过氧化氢制取少量氧气:4MnO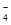 +4H2O2+12H+=4Mn2++7O2↑+10H2O +4H2O2+12H+=4Mn2++7O2↑+10H2O |
D.用惰性电极电解硫酸铜溶液:2Cu2++ 2H2O  2Cu↓ +O2↑ +4H+ 2Cu↓ +O2↑ +4H+ |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,11.2 L乙醇所含的羟基数为0.5NA |
| B.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA |
| C.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA |
| D.电解硫酸铜溶液时,阳极每生成标准状况下3.36L气体,电路中转移电子数为0.3NA |
三种不同物质有如图所示转化关系:甲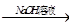 乙
乙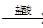 丙
丙 甲,则甲不可能是
甲,则甲不可能是
| A.Al2O3 | B.SiO2 | C.CO2 | D.NH4Cl |
关于下列各实验装置图的叙述中,正确的是
| A.装置①可用于分离苯和溴苯的混合物 |
| B.装置②可用于吸收HCl或NH3气体 |
| C.装置③可用于分解NH4Cl制备NH3 |
| D.装置④b口进气可收集CO2或NO气体 |