(共10分)已知某有机物中n(C): n(H)="1," 将W1g该有机物在足量氧气中充分燃烧,消耗标准状况下的氧气V L,产物只有CO2和H2O,且m(CO2)=w2g,m(H2O)=W3g。
(1)若通过计算来确定该有机物是否含氧,除已知的碳氢原子个数比外,还至少需上述数据中的 个,这几个数据的组合共有 种,将这些组合一一填入下列空格中。
说明:①选用V、W1、W2、W3表示,不必列出具体计算式;
②每个空格中填一种组合,有几种组合就填几种,不必填满。
| |
|
|
|
| |
|
|
|
(2)当W1与V之间满足 条件时,该有机物中一定没有氧原子,当W1与V之间满足 条件时,该有机物中一定含有氧原子。
(3)W1g有机物中含氧的质量为 g。(用含W1、W2的代数式表示)
下图为A、B、C、D、E五种物质的相互转化关系,请按如下要求填空: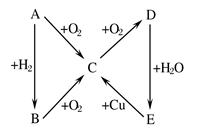
(1)若A是气体单质,则A的结构式为,B的电子式为,由D生成E的反应的化学方程式是;
(2)若A为固体单质,则A元素在元素周期表中的位置是在第周期第族,由E生成C的反应的化学方程式是。
下列物质①铁②干冰③金刚石④铜⑤水晶⑥氯化钠⑦单质碘⑧氢氧化钠【请用编号回答(1)和(2)小题】
(1)属于离子晶体的是,属于分子晶体的是,属于原子晶体的是,属于金属晶体的是;
(2)只含共价键(不含分子间作用力)的化合物是,只含离子键的是,既含共价键又含离子键的是;
(3)写出电子式:干冰,氢氧化钠。
(4)写出结构式:干冰,单质碘
在浓硝酸中放入铜片:
(1)反应开始时,实验现象为。
反应的化学方程式为;
(2)反应结束后,若铜有剩余,反应接近结束时的化学反应方程式为:
;
某化学兴趣小组同学进行如下实验。
(1)使用铜和稀硫酸制备硫酸铜晶体。步骤如下: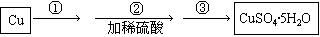
步骤①观察到的现象是:。
步骤③的主要操作包括:。
(2)某同学查资料知:铜与稀硫酸不反应,若在稀硫酸中加入H2O2,铜可逐渐溶解。实验装置如图,写出该反应的化学方程式:。
(3)铜粉放入稀硫酸中,加热后无明显现象发生。当加入一种物质后,铜粉开始溶解,溶液变蓝色,同时有气体逸出,该物质是(填字母);
| A.Al2(SO4)3 | B.Na2CO3 | C.KNO3 | D.FeSO4 |
写出该反应的离子方程式。
在不同温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数K如下表:
CO(g)+H2O(g)的平衡常数K如下表:
| 温度/℃ |
700 |
800 |
850 |
1000 |
1200 |
| 平衡常数K |
2.6 |
1.7 |
1 |
0.9 |
0.6 |
(1)该反应的△H0。(填“>”、“=”或“<”)。若到达平衡后升高温度,则CO2的转化率将,正反应速率(填“增大”、“减小”或“不变”)。
(2)850℃时发生上述反应,CO2的转化率随时间变化如图所示。其他条件相同时,请在下图中画出700℃时CO2的转化率随时间变化的示意图(注明必要的标示)。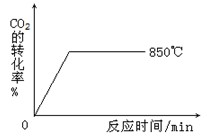
(3)在850℃时发生上述反应,以下表中的物质的量投入恒容反应器,其中向正方向移动的组是(填代号),平衡后与C中各物质的百分含量相等的组有__________(填代号 )
| A |
B |
C |
D |
E |
|
| n(CO2)[ |
3 |
1 |
0 |
1 |
1 |
| n(H2) |
2 |
1 |
0 |
1 |
2 |
| n(CO) |
1 |
2 |
3 |
0.5 |
3 |
| n(H2O) |
5 |
2 |
3 |
0.5 |
1 |
(4) 850℃时,在1L的密闭容器中分别充入2mol的CO2和H2,计算反应到达平衡时CO的物质的量浓度。(写出计算过程)