下列有关原子结构和元素周期律的表述正确的是
①原子序数为15的元素的最高化合价为+3;②ⅦA族元素是同周期中非金属性最强的元素;③第二周期ⅣA族元素的原子核电荷数和中子数一定为6;④原子序数为12的元素位于元素周期表的第三周期ⅡA族
| A.①② | B.①③ | C.②④ | D.③④ |
在实验室中,用右图所示装置(尾气处理装置略去)进行下列实验,将①中液体逐滴滴入到②中。实验结果与预测的现象一致的是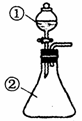
| 选项 |
①中的物质 |
②中的物质 |
预测②中的现象 |
| A |
氨水 |
氯化铝溶液 |
产生白色沉淀 |
| B |
浓硫酸 |
铜片 |
产生大量气体,溶液变蓝 |
| C |
浓硝酸 |
用砂纸打磨过的铝条 |
产生大量红棕色气体 |
| D |
稀盐酸 |
碳酸钠与氢氧化钠的混合溶液 |
立即产生大量气体 |
下列各组离子一定能大量共存的是
| A.某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42- |
| B.能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32- |
| C.加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl- |
| D.常温下pH=12的溶液: K+、Ba2+、Cl-、NO3- |
下列离子方程式正确的是
| A.石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O |
| B.钠与硫酸铜溶液反应:Cu2++2Na=2Na++Cu |
| C.铁屑溶于过量稀硝酸:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O |
| D.FeI2溶液中通入少量氯气:2Fe2++Cl2=2Fe3++2Cl- |
下列说法正确的是
| A.SO2和CO都是酸性氧化物,都能与水反应生成酸 |
| B.Na2O和Na2O2组成元素相同,与CO2反应产物也完全相同 |
| C.Al2O3和Na2O按物质的量比1:1投入水中可得到澄清溶液 |
| D.金属铝排在金属活动性顺序表中氢元素的前面,铝与强酸反应一定放出氢气 |
下表中对应关系错误的是
| A |
NaCl=Na++Cl- NH3•H2O⇌NH4++OH- |
均属于电离方程式 |
| B |
Ba2++SO42-=BaSO4↓ HCO3-+OH-=CO32-+H2O |
均可表示一类反应 |
| C |
SO2使酸性高锰酸钾溶液褪色; SO2使碱性酚酞溶液褪色 |
均属于SO2的同一性质 |
| D |
Cl2+2NaOH=NaClO+NaCl+ H2O; 3S+6NaOH=2Na2S+Na2SO3+3H2O |
Cl2和S在反应中即作氧化剂又作还原剂 |