在基态多电子原子中,关于核外电子能量的叙述错误的是 ( )
| A.最易失去的电子能量最高 |
| B.电离能最小的电子能量最高 |
| C.p轨道电子能量一定高于s轨道电子能量 |
| D.在离核最近区域内运动的电子能量最低 |
对某酸性溶液(可能含有Br-,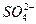 ,H2SO3,
,H2SO3, )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其中原溶液中是否存在的是()
| A.Br- |
B.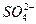 |
| C.H2SO3 |
D. |
用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液浓度偏低的操作是()
| A.碱式滴定管用蒸馏水洗后,未用待测液润洗 |
| B.酸式滴定管用蒸馏水洗后,未用标准液润洗 |
| C.滴定中,不慎将锥形瓶中少量待测液体摇出瓶外 |
| D.滴定前酸式滴定管尖嘴部分未充满溶液 |
某碳酸钾样品中的杂质含有纯碱、硝酸钾、硝酸钡中的一种或两种。取7.8 g该样品溶于适量水中得到澄清溶液,再加入过量CaCl2溶液得到沉淀5.0 g。下列对原样品中所含杂质的判断正确的是()
| A.一定没有Na2CO3和Ba(NO3)2 |
| B.一定有Na2CO3而没有Ba(NO3)2 |
| C.没有Ba(NO3)2但有KNO3,可能还有Na2CO3 |
| D.没有Na2CO3但有Ba(NO3)2和KNO3 |
在一支50.00 mL的酸式滴定管中盛入0.1 mol·L-1HCl溶液,液面恰好在20.00 mL刻度处,若将管内的酸液全部放完,刚好中和锥形瓶内盛装的30 mL NaOH溶液,此碱液的物质的量浓度为()
| A.0.1 mol·L-1 |
| B.<0.1 mol·L-1 |
| C.>0.1 mol·L-1 |
| D.不能确定 |
向某溶液中加BaCl2溶液,产生白色沉淀,加稀HNO3沉淀不消失,则溶液中()
A.一定含有 、Ag+中的一种或几种 、Ag+中的一种或几种 |
B.一定含有 或Ag+,不含 或Ag+,不含 |
C.一定含有 或 或 或Ag+ 或Ag+ |
D.一定含 、 、 、Ag+中的一种或几种 、Ag+中的一种或几种 |