A、B、C三支试管中分别盛有Cl-、Br-、I-的溶液,向A试管中加入新制的氯水和CCl4,出现分层,下层为橙红色,再将此溶液倒入C试管中,无变化,则A、B、C三支试管中所盛有的离子依次是
A.I-、Br-、Cl- B.Br-、I-、Cl- C.Cl-、I-、Br- D.Br-、Cl-、I-
可逆反应:2NO2 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
已知断裂1 mol C—H键,要吸收热量414.4 kJ;断裂1 mol C—C键,要吸收热量347.4 kJ;生成1 mol C=C键,会放出热量615.3 kJ;生成1 mol H—H键,会放出热量435.3 kJ,某有机物分解的反应可表示为: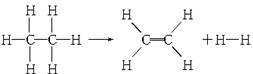
若在反应中消耗了1 mol乙烷,则有关该反应的说法正确的是
| A.该反应放出251.2 kJ的热量 | B.该反应吸收251.2 kJ的热量 |
| C.该反应放出125.6 kJ的热量 | D.该反应吸收125.6 kJ的热量 |
据报道,我国拥有完全自主产权的氢氧燃料电池车已在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液。下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-===4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.该电池工作时每消耗1 mol O2,有2 mol电子转移 |
下列关于原子结构、元素性质的说法正确的是
| A.非金属元素组成的化合物中只含共价键 |
| B.ⅠA族金属元素是同周期中金属性最强的元素 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |
下列说法正确的是
| A.第二周期元素从C到F,非金属性逐渐减弱 |
| B.第三周期元素从Na到Cl,原子半径逐渐增大 |
| C.HF、HCl、HBr、HI的热稳定性依次逐渐增强 |
| D.LiOH、NaOH、KOH的碱性依次逐渐增强 |