“酒是陈的香”就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室和工业上常采用如下反应: 来制取乙酸乙酯。
来制取乙酸乙酯。
(1)实验时,试管B观察到的现象是界面处产生浅红色,下层为蓝色,振荡后产生气泡,界面处浅红色消失,原因是(用化学方程式表示) 。 欲从上述混合物中分离出乙酸乙酯,采用的分离方法是 (填操作名称)
(2)事实证明,此反应以浓 为催化剂,也存在缺陷,其原因可能是 。
为催化剂,也存在缺陷,其原因可能是 。
a.浓H2SO4易挥发,以至不能重复使用 b.会使部分原料炭化
c.浓H2SO4有吸水性 d.会造成环境污染
乙酸丁酯:(CH3COOCH2CH2CH2CH3)是一种常用的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质下表。
第一步:将过量的丁醇和乙酸混合加热发生酯化反应;
第二步:水洗提纯;
第三步:蒸馏提纯。
(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→→→→。
(2)C装置中除了装有乙酸和过量的1-丁醇外,还需要加入_________、_____ ___ 。
(3)装置C中冷凝管的作用是:;冷凝水应从___________(填“c”或“d”)进入冷凝管
(4)步骤F酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ _ _ __。
(5)装置A的分液漏斗中液体分为两层,乙酸丁酯应在(填上、下)层;B装置蒸馏时,接收乙酸丁酯前(温度<126.3℃)锥形瓶中得到的物质是、。
根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么
(近似值)的实验。先称量反应物氧化铜的质量
(
),反应完全后测定生成物水的质量 (
),由此计算
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的
与
的量足以产生使
完全还原的氨气):
(
),由此计算
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的
与
的量足以产生使
完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)
→;
(3)在本实验中,若测得
(
)="
"
,
(
2
)= "
"
,则
=;
(4)在本实验中,使测定结果
偏大 的是 (填序号);
的是 (填序号);
①
未完全起反应②
不 干燥
干燥
③
中混有不反应的杂质④碱石灰不干燥
⑤
与
混合物不干燥
(5)在本实验中,还可通过测定和,或和达到实验目的。
某兴趣小组用题图装置探究氨的催化氧化.
(1)氨催化氧化的化学方程式为.
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是反应(填"吸热"或"放热").
(3)为保证在装置4中观察到红棕色气体,装置3应装入;若取消3,在4中仅观察到大量白烟,原因是.
(4)为实现氨催化氧化,也可用装置5替换装置(填装置代号);化合物
为(只写一种),
的作用是.
碘被称为"智力元素",科学合理地补充碘可防止碘缺乏病。碘酸钾(
)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题:
(1)碘是(填颜色)固体物质,实验室常用方法来分离提纯含有少量杂 质的固体碘。
质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为;阴极上观察到的实验现象是。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有
。请设计一个检验电解液中是否有
的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
步骤②的操作名称是,步骤⑤的操作名称是。步骤④洗涤晶体的目的是.
某化学兴趣小组为探究
的性质,按下图所示装置进行实验。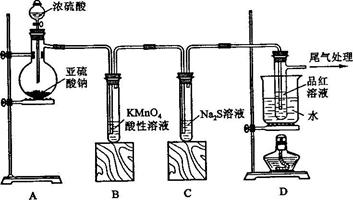
请到答
列问题:
(1)装置
中盛放亚硫酸钠的仪器名称是,其中发生反 应的化学方程式为;
应的化学方程式为;
(2)实验过程中,装置
、
中发生的现象分别是、,这些现象分别说明
具有的性质是和;装置B中发生反应的离子方程式为;
(3)装置
的目的是探究
与品红作用的可逆性,请写出实验操作及象;
(4)尾气可采用 溶液吸收。
溶液吸收。