以NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+ O2(g)=2CO2(g)+H2O(l);ΔH=-1300 kJ/mol的说法中,错误的是
O2(g)=2CO2(g)+H2O(l);ΔH=-1300 kJ/mol的说法中,错误的是
| A.有10NA个电子转移时,放出1300 kJ的能量 |
| B.有4NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
| C.C2H2的燃烧热为1300 kJ/mol |
| D.该热化学方程式还可表示为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH=-2600 kJ/mol |
下列关于有机物的说法错误的是
| A.乙烯和苯都能使溴水褪色,褪色的原因不相同 |
| B.石油和天然气的主要成分都是碳氢化合物 |
| C.苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 |
| D.甲烷与氯气反应生成一氯甲烷和苯与硝酸反应生成硝基苯的反应类型相同 |
下列说法中正确的是
| A.化学的特征就是认识分子和制造分子 |
| B.在任何条件下,1mol任何气体的体积都约是22.4L |
| C.在化学反应中,参加反应的各物质的质量比等于其物质的量之比 |
| D.俄国化学家门捷列夫提出原子学说,为近代化学的发展奠定了坚实的基础 |
据报道,反式脂肪酸目前被广泛添加于加工食品中,而反式脂肪酸会导致心脏病和糖尿病等疾病。已知某种反式脂肪酸的结构简式为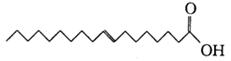 ,下列判断不正确的是
,下列判断不正确的是
| A.该物质与丙烯酸互为同系物 |
| B.该物质的分子式为C18H34O2 |
| C.该物质易溶于水,在空气中不易变质 |
| D.该物质的碳链含有锯齿形结构 |
等浓度的下列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的pH由小到大排列正确的是
| A.④②③① | B.③①②④ | C.①②③④ | D.①③②④ |
下列与有机物结构、性质相关的叙述错误的是
| A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2 |
| B.蛋白质和油脂都属于高分子化合物,一定条件下能水解 |
| C.甲烷和氯气反应生成一氯甲烷、苯和硝酸反应生成硝基苯的反应类型相同 |
D.苯 不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 |