(1)炼钢和炼铁的原理都是利用氧化还原反应,但炼铁的原理是 ,其核心反应是 ,而炼钢的原理主要是 ,
(2)炼铁时常用焦炭形成还原剂,能用煤代替吗? ,为什么? 。
(3)检查钢质设备完好性的方法之一是:在被怀疑有裂纹处涂上10%的盐酸,过一段时间如观察到有粗线裂纹,表明该部分原先确有裂纹,产生粗线裂纹的原因是 。
已知X、Y、Z、W四种元素分别是元素周期表中三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________、Z__________。
(2)由以上元素中两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为:___________,它的共价键属于__________(填:极性、非极性)键;含有离子键和非极性共价键的化合物的电子式为____________。
(3)由X、Y、Z所形成的常见离子化合物是___________,该化合物与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式为:____________ ;X与W形成的化合物与水反应时,水作的是__________(填:氧化剂、还原剂)。
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
(1)请根据甲同学的意图,连接相应的装置,接口顺序:
b接 , 接_______, 接a。
(2)U形管中所盛试剂的化学式为 。
(3)装置③中CCl4的作用是 。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3 溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在______之间(填装置序号)。瓶中可以放入 。
(8分)非金属单质及其化合物在生产和科研中都有重要应用。
(1) 若发生大量氯气泄漏事故,下列措施中正确的是_________。
a.立即通报相关部门,迅速撤离事故现场
b.用蘸有肥皂水的毛巾捂住口鼻立即逆风疏散
c.用蘸有NaOH溶液的毛巾捂住口鼻立即顺风疏散
(2) 事故发生后,可用NaOH稀溶液处理泄漏的氯气,反应的离子方程式是________。
(3) 向Na2SO3和Na2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是__________
(4) Cl2与NO2在一定条件下发生化合反应,生成一种气体,实验数据如图。图中横坐标是加入C12的物质的量,纵坐标是反应后气体物质的量总和。已知所取C12、NO2的物质的量总和为6 mol。则生成物的化学式是__________。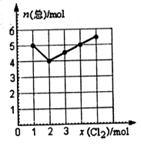
粉煤灰是燃煤电厂排出的工业废渣,其中含莫来石(Al6Si2O13)的质量分数为43.4% ,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
,还有含量较多的SiO2(其他成分不含Al和Si)。用粉煤灰和纯碱在高温下烧结,可制取NaAlSiO4(霞石)、Na2SiO3和NaAlO2,有关化学方程式为:
Al6Si2O13+3Na2CO3→2NaAlSiO4+4NaAlO2+3CO2↑ ①
Al6Si2O13+5Na2CO3→2Na2SiO3+6NaAlO2+5CO2↑②
SiO2+Na2CO3→Na2SiO3+CO2↑③
(1)粉煤灰中铝的质量分数为%。
(2)用l mol Al6Si2O13和4mol SiO2制得5mol NaAlO2、lmolNaAlSiO4,还应制得Na2SiO3 mol,共消耗Na2CO3mol(得到的固体中无SiO2)。
(3)若粉煤灰中Al6Si2O13与SiO2的物质的量之比为1:2,则1妇粉煤灰与6molNa2CO3反应(反应物全部都参与反应),可制得NaAlO2 mol。
(4)若用100 mol Al6Si2O13同时生产NaAlSiO4和NaAlO2,且n(NaAlSiO4):n(NaAlO2)=x,消耗Na2CO3 ymol,试确定y与x的关系式。
白玉的化学式可用CaxMgySipO22(OH)2表示(也可用Ca、Mg、si、H的氧化物表示、。
(1)取8.10g白玉粉末灼烧至恒重,固体减少了0.18g,则白玉的摩尔质量为g/mol。
(2)另取4.05g白玉粉末加入lmol/L的盐酸100mL中充分溶解,得不溶物2.40g。过滤,将滤液和洗涤液合并后往其中加入足量的铁屑,得到气体336mL(STP)。则①p= ;②白玉的化学式为。
;②白玉的化学式为。