A、B、C、D、E、F、G都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族,D、G同主族。A、C能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。B元素原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素。根据以上信息回答下列问题:
⑴写出A、C、E三种元素的符号:
A , C , E 。
⑵甲、乙两分子中含有非极性共价键的是 (填分子式)。
⑶ C、D、F的离子中,半径最小的是 (填离子符号)。.
⑷在气态单分子化合物FG3中元素F的杂化方式为: 杂化,FG3的空间构型为 。
(9分)A~G有以下转化关系: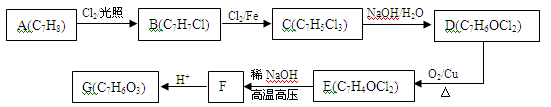
已知:①E能发生银镜反应;
②C中苯环上有三个互不相邻的取代基
③G分子遇氯化铁溶液显紫色。
(1)B的结构简式为_______________,G的结构简式为________________。
(2)C→D的反应类型是____________,E分子中含氧官能团的名称是_______________。
(3)B物质有许多同分异构体,除B外其他三种含有苯环的同分异构体的结构简式分别为
_________________、________________、__________________。
(4)D→E的化学方程式为___________________________。
(6分)某有机化合物A的相对分子质量(分子量)大于100,小于110。经分析得知,其中C和H的质量分数之和为53.8%,其余为氧。请回答:
(1)1个A分子中含有_______个氧原子,该化合物的相对分子质量是____________。
(2)已知A分子中C、H原子个数比=1:2,则A的分子式是_______。
(3)已知A可与碳酸钠溶液反应生成二氧化碳,A的核磁共振氢谱为3组峰,且面积比为6:1:1,则A的结构简式为_______________。
(6分)(1)相同物质的量的①C2H4②C2H6O完全燃烧,消耗氧气物质的量关系为______(填编号,用“>”或“=”表示)。
(2) 的分子式为______________。
的分子式为______________。
(3)在1个 分子中,处于同一平面上的原子数最多可能有____个。
分子中,处于同一平面上的原子数最多可能有____个。
(4)1mol醛基与足量银氨溶液完全反应生成Ag的物质的量为________。
(5)高聚物 的单体为__________、___________。
的单体为__________、___________。
聚合氯化铝铁(PAFC)是一种高效净水剂,其组成可表示为[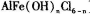 ]。
]。
为检测PAFC中Al的含量,采用下图所示流程。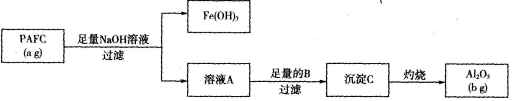
(1)PAFC中铁元素的化合价为_______.
(2)溶液A中含铝元素的溶质是______,它属于____(填“酸”、“碱”、“盐”)。
(3)如图所示,过滤操作中的一处错误是__________________.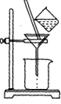
(4)物质B可能是下列试剂中的_______(填代号)。
a.NH3b.CO2c.NaOH溶液d.HNO3溶液
判断流程中沉淀C是否洗净的方法是______________________(描述操作、现象和结论)。
(5)PAFC中A1元素的质量分数为____________(用含有a、b的代数式表示)。
甲、乙、丙、X是中学化学中常见的物质,在一定条件下,它们之间的转化关系如下图所示(部分产物已略去)。请回答下列问题:
(1)若X是 O2,则甲不可能是______(填代号)
a.Mgb.N2c.Sd.Al
(2)若甲能使湿润的红色石蕊试纸变蓝,丙为红棕色气体。写出甲转化为乙的化学方程式:________________________________________。
(3)若乙是一种常见的温室气体,则X的化学式为__________。
(4)若丙为淡黄色粉末,常用作呼吸面具中的供氧剂,则丙与水反应的离子方程式为______;1mol丙与水发生反应时转移电子的物质的量为______mol。
(5)若X是一种常见的金属单质,常温下甲的浓溶液可盛放在铝制容器中,丙为浅绿色溶液。
①检验乙是否完全转化为丙的试剂为_______(填试剂名称)。
②保存丙溶液常加入少量X,其目的是____________。